题目内容
【题目】2019年诺贝尔化学奖由来自美、英、日的三人分获,以表彰他们在锂离子电池研究方面做出的贡献,他们最早发明用LiCoO2作离子电池的正极,用聚乙炔作负极。回答下列问题:
(1)基态Co原子价电子排布图为______________(轨道表达式)。第四电离能I4(Co)比I4(Fe)小,是因为_____________________。
(2)LiCl的熔点(605℃)比LiF的熔点(848℃)低,其原因是_________________________.
(3)乙炔(C2H2)分子中δ键与π键的数目之比为_______________。
(4)锂离子电池的导电盐有LiBF4等,碳酸亚乙酯( )是一种锂离子电池电解液的添加剂。
)是一种锂离子电池电解液的添加剂。
①LiBF4中阴离子的空间构型是___________;与该阴离子互为等电子体的分子有_____________。(列一种)
②碳酸亚乙酯分子中碳原子的杂化方式有_______________________。
(5)Li2S是目前正在开发的锂离子电池的新型固体电解质,其晶胞结构如图所示,已知晶胞参数a=588pm。

①S2-的配位数为______________。
②设NA为阿伏加德罗常数的值,Li2S的晶胞密度为____________(列出计算式)![]() 。
。
【答案】![]() Co失去的是3d6上的一个电子,而
Co失去的是3d6上的一个电子,而![]() 失去的是半充满状态3d5上的一个电子,故
失去的是半充满状态3d5上的一个电子,故![]() 需要的能量较高 LiCl和LiF均为离子晶体,Cl-半径比F-大,LiCl的晶格能比LiF的小 3:2 正四面体 CF4 sp2、sp3 8
需要的能量较高 LiCl和LiF均为离子晶体,Cl-半径比F-大,LiCl的晶格能比LiF的小 3:2 正四面体 CF4 sp2、sp3 8 ![]()
【解析】
(1)基态Co原子价电子排布式为3d74s2,再得价电子排布图;Co3+为3d6,Fe3+为3d5,Fe3+半满,稳定,难失去电子,因此得到结论。
(2)LiCl与LiF都为离子晶体,主要比较离子晶体中离子半径,键能和晶格能。
(3)乙炔(C2H2)分子中碳碳三键,因此可得分子δ键与π键的数目之比。
(4)①先计算LiBF4中阴离子的电子对,再得空间构型,根据左右价电子联系得出与该阴离子互为等电子体的分子。
②分别分析碳酸亚乙酯分子中每个碳原子的δ键和孤对电子得到结论。
(5)①以最右面中心S2-分析,分析左右连接的锂离子个数。
②先计算晶胞中有几个硫化锂,再根据密度公式进行计算。
(1)基态Co原子价电子排布式为3d74s2,其价电子排布图为![]() ;第四电离能I4(Co)比I4(Fe)小,其Co3+为3d6,Fe3+为3d5,Fe3+半满,稳定,难失去电子,因此原因为Co失去的是3d6上的一个电子,而
;第四电离能I4(Co)比I4(Fe)小,其Co3+为3d6,Fe3+为3d5,Fe3+半满,稳定,难失去电子,因此原因为Co失去的是3d6上的一个电子,而![]() 失去的是半充满状态3d5上的一个电子,故
失去的是半充满状态3d5上的一个电子,故![]() 需要的能量较高,故答案为:
需要的能量较高,故答案为:![]() ;Co失去的是3d6上的一个电子,而
;Co失去的是3d6上的一个电子,而![]() 失去的是半充满状态3d5上的一个电子,故
失去的是半充满状态3d5上的一个电子,故![]() 需要的能量较高。
需要的能量较高。
(2)LiCl的熔点(605℃)比LiF的熔点(848℃)低,它们都为离子晶体,离子晶体熔点主要比较半径,键能和晶格能,因此其原因是LiCl和LiF均为离子晶体,Cl-半径比F-大,LiCl的晶格能比LiF的小,故答案为:LiCl和LiF均为离子晶体,Cl-半径比F-大,LiCl的晶格能比LiF的小。
(3)乙炔(C2H2)分子中碳碳三键,因此分子δ键与π键的数目之比为3:2,故答案为:3:2。
(4)①LiBF4中阴离子的电子对为![]() ,因此空间构型是正四面体型;B-的价电子等于C的价电子,因此与该阴离子互为等电子体的分子有CF4,故答案为:正四面体;CF4。
,因此空间构型是正四面体型;B-的价电子等于C的价电子,因此与该阴离子互为等电子体的分子有CF4,故答案为:正四面体;CF4。
②碳酸亚乙酯分子中碳氧双键的碳原子,δ键有3个,没有孤对电子,因此杂化方式为sp2,另外两个碳原子,δ键有4个,没有孤对电子,因此杂化方式为sp3,所以碳原子的杂化方式有sp2、sp3,故答案为:sp2、sp3。
(5)①以最右面中心S2-分析,连接左边有4个锂离子,右边的晶胞中也应该有4个锂离子,因此配位数为8,故答案为:8。
②设NA为阿伏加德罗常数的值,根据晶胞计算锂离子有8个,硫离子8个顶点算1个,6个面心算3个即总共4个,Li2S的晶胞密度 ,故答案为:
,故答案为:![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大。其相关信息如下表所示:
X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
Z元素的族序数是其周期数的三倍 |
W原子的第一至第六电离能分别为:I1=578KJ·mol-1I2=1817KJ·mol-1I3=2745KJ·mol-1 I4=11575KJ·mol-1I5=14830KJ·mol-1I6=18376KJ·mol-1 |
Q为前四周期中电负性最小的元素 |
元素R位于周期表的第10列 |
回答下列问题:
(1)Y元素的基态原子中未成对电子数为______;X、Y、Z三种元素原子的第一电离能由小到大的顺序为____________(用元素符号表示)。
(2)W的氯化物的熔点比Q的氯化物的熔点__________(填“高”或“低”),理由是__________________________________________________。
(3)光谱证实元素W的单质与强碱性溶液反应有[W(OH)4]-生成,则[W(OH)4]-中存在(填字母)_____________。
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
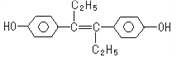
(4)含有X、R和镁三种元素的某种晶体具有超导性,其结构如下图所示。则该晶体的化学式为_______;晶体中每个镁原子周围距离最近的R原子有_______个。
【题目】温度为T 时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,
反应:PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡,反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡,反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 250 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A. 反应在前50 s内的平均速率v(PCl3)=0.0032mol/(L·s)
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol/L,该反应为放热反应
C. 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,达到平衡前的v正>v逆
D. 相同温度下,起始时向容器中充入2.0 mol PCl3、2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%