题目内容
【题目】金属及其化合物有许多重要的用途
(1)碳酸钠可用于从海水提取溴,涉及的反应如:
3Br2+6Na2CO3+3H2O=5NaBr+NaBrO3+6NaHCO3
在上述反应中用双线桥标出电字转移的方向和数目,该反应中氧化剂与还原剂的物质的量之比是_____________。
(2)少量的钠应保存在_______中;钠着火时应采取的灭火措施是:__________。
(3)过氧化钠作潜艇供氧剂时发生的化学反应方程式是_____________。
(4)加热Al片的实验现象是_________________,原因是_____________。
(5)检验KCl中阳离子的方法及现象是___________。
【答案】
(1)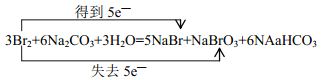 ;5:1;
;5:1;
(2)煤油或石蜡油;用干燥的沙土灭火;
(3)2Na2O2+2CO2=2Na2CO3+O2(或2Na2O2+2H2O=4NaOH+O2↑) ;
(4)Al片失去光泽,熔化而不滴落,像一层膜兜着;Al2O3熔点很高,且高于Al;
(5)焰色反应;透过蓝色钴玻璃观察到有紫色火焰;
【解析】
试题分析:(1)反应3Br2+6NaOH=5NaBr+NaBrO3+3H2O中,溴元素的化合价由0价分别变为-1价和+5价,溴既是氧化剂又是还原剂,氧化产物是溴酸钠,还原产物是溴化钠,由化学方程式可知氧化剂和还原剂物质的量之比为5:1,用双线桥标出电子转移的方向和数目为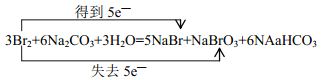 ,故答案为:
,故答案为: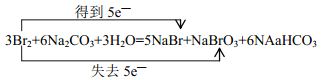 ,5:1;
,5:1;
(2)因为钠的密度比水小比煤油大及其性质特别活泼易与水发生反应,所以少量的钠应保存在煤油中;钠着火时应采取的灭火措施是:用干的沙土灭火;故答案为:煤油;用干的沙土灭火;
(3)过氧化钠和二氧化碳反应生成碳酸钠和氧气,该反应为2Na2O2+CO2═2Na2CO3+O2,故答案为:2Na2O2+CO2═2Na2CO3+O2;
(4)氧化铝的熔点很高,加热Al片时,内部的铝熔化,而外层的氧化铝未熔化,实验现象为Al片失去光泽,熔化而不滴落,像一层膜兜着;Al2O3熔点很高,且高于Al,故答案为:Al片失去光泽,熔化而不滴落,像一层膜兜着;Al2O3熔点很高,且高于Al;
(5)检验KCl中阳离子可以选用焰色反应,透过蓝色钴玻璃观察到有紫色火焰,故答案为:焰色反应;透过蓝色钴玻璃观察到有紫色火焰。
