题目内容
16.俄罗斯科学家在利用回旋加速器进行的实验中,用含20个质子的钙元素的同位素反复轰击含95个质子的镅元素,结果4次成功制成4个第115号元素的原子.这4个原子在生成数微秒后衰变成第113号元素.前者的一种核素为${\;}_{115}^{288}$X.下列有关叙述正确的是( )| A. | X元素的核外电子数为288 | |
| B. | 核素${\;}_{115}^{288}$X的质量数与中子数之差为173 | |
| C. | 113号元素属于非金属元素 | |
| D. | 115号元素的最高正化合价是+5 |
分析 A.电子数=质子数;
B.质子数=质量数-中子数;
C.112号元素为第七周期第ⅡB族元素,113号元素位于第ⅢA族;
D.113号元素为第七周期第IIIA族元素,则115号元素位于第ⅤA族.
解答 解:A.${\;}_{115}^{288}$X的质子数为115,电子数=质子数=115,故A错误;
B.${\;}_{115}^{288}$X的质量数为288,质子数为115,质子数=质量数-中子数,则质量数与中子数之差为115,故B错误;
C.112号元素为第七周期第ⅡB族元素,113号元素位于第ⅢA族,由同主族元素性质变化规律可知,属于金属元素,故C错误;
D.113号元素为第七周期第IIIA族元素,则115号元素位于第ⅤA族,其最高正价为+5,故D正确;
故选D.
点评 本题考查原子结构与元素的性质,把握元素周期表中现有元素及112号元素的位置为解答的关键,注意选项A为解答的易错点,题目难度不大.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
7.在一定条件下,向2L密闭容器中充入3mol X气体和1mol Y气体,发生下列反应:2X(气)+Y(气)?3Z(气)+2W(气),在某时刻测定出的下列各生成物的浓度,一定不正确的是( )
| A. | c(Z)=0.45 mol•L-1 | B. | c(Z)=1.20 mol•L-1 | C. | c(W)=1.00 mol•L-1 | D. | c(W)=0.80 mol•L-1 |
11.以下关于化学实验中“先与后”的说法中正确的是( )
①加热试管时,先均匀加热,后局部加热;
②用排水法收集气体时,先移出导管后撤酒精灯;
③制取物质时,先检查装置气密性后装药品;
④使用容量瓶、分液漏斗、滴定管前,先检查是否漏水后洗涤干净;
⑤做H2还原CuO实验时先加热CuO后通H2;反应完毕后,先撤酒精灯待试管冷却后停止通H2.
①加热试管时,先均匀加热,后局部加热;
②用排水法收集气体时,先移出导管后撤酒精灯;
③制取物质时,先检查装置气密性后装药品;
④使用容量瓶、分液漏斗、滴定管前,先检查是否漏水后洗涤干净;
⑤做H2还原CuO实验时先加热CuO后通H2;反应完毕后,先撤酒精灯待试管冷却后停止通H2.
| A. | 除②以外 | B. | 除④以外 | C. | 除⑤以外 | D. | 全部正确 |
8.下列变化过程和对应的能量转化关系错误的是( )
| A. | 植物光合作用:光能→生物质能 | B. | 太阳能热水器:太阳能→电能 | ||
| C. | 石灰石高温分解:热能→化学能 | D. | 铅蓄电池:化学能→电能 |
20.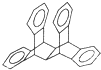 科罗拉多大学的克利斯托(S.Cristol)等人合成了一种有机分子,这种分子让他想起罗马的两面神Janus--罗马的守门神,克利斯托的同事迈金泰(Macintyre)就建议将该分子叫做Janusene.该有机物的结构简式如图所示,下列说法正确的是( )
科罗拉多大学的克利斯托(S.Cristol)等人合成了一种有机分子,这种分子让他想起罗马的两面神Janus--罗马的守门神,克利斯托的同事迈金泰(Macintyre)就建议将该分子叫做Janusene.该有机物的结构简式如图所示,下列说法正确的是( )
 科罗拉多大学的克利斯托(S.Cristol)等人合成了一种有机分子,这种分子让他想起罗马的两面神Janus--罗马的守门神,克利斯托的同事迈金泰(Macintyre)就建议将该分子叫做Janusene.该有机物的结构简式如图所示,下列说法正确的是( )
科罗拉多大学的克利斯托(S.Cristol)等人合成了一种有机分子,这种分子让他想起罗马的两面神Janus--罗马的守门神,克利斯托的同事迈金泰(Macintyre)就建议将该分子叫做Janusene.该有机物的结构简式如图所示,下列说法正确的是( )| A. | 该有机物属于苯的同系物 | |
| B. | 该有机物完全燃烧生成CO2和H2O的物质的量之比为15:11 | |
| C. | 该有机物的一氯代物只有4种 | |
| D. | 该有机物既能发生取代反应又能发生加成反应 |

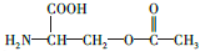 .
.
 +CO$→_{△}^{HCl}$
+CO$→_{△}^{HCl}$ .
.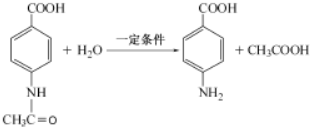 .
.



 次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题: