题目内容
5.1000mL某待测液中除含有0.2mol•L-1的Na+外,还可能含有下列离子中的一种或多种:| 阳离子 | K+、NH4+、Fe3+、Ba2+ |
| 阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |

(1)写出生成白色沉淀B的离子方程式:HCO3-+Ba2++OH-=BaCO3↓+H2O.
(2)待测液中肯定不存在的阳离子是Fe3+、Ba2+.
(3)若无色气体D是混合气体:
①待测液中一定含有的阴离子是CO32-、HCO3-、SO32-.
②沉淀A中能还原稀硝酸的成分是BaSO3(写化学式).
分析 (1)(2)待测液和氯化钡溶液反应得到沉淀A,则溶液中可能含有CO32-、SO32-、SO42-,向沉淀中加入稀硝酸生成气体,且有部分沉淀不溶解,则溶液中存在CO32-,可能存在SO32-、SO42-中的两种或一种,根据离子共存知,溶液中不存在Ba2+;
滤液A中有Ba2+,加入过量的NaOH溶液得到气体B、白色沉淀B,则溶液中一定含有NH4+、HCO3-,一定不存在Fe3+,气体B为NH3,白色沉淀B为BaCO3,滤液B中通入氯气,得浅黄绿色溶液,溶液中一定没有Br-,滤液B中加入硝酸银、硝酸溶液得到白色沉淀C,C为AgCl,说明滤液B中含有Cl-,由于加入氯化钡溶液,不能确定原溶液中是否含有Cl-;
(3)若无色气体D是混合气体,只能为CO2、NO混合气体,白色沉淀D只能为BaSO4,溶液中一定含有SO32-,不能确定是否含有SO42-,沉淀A中一定含有BaCO3,BaSO3.
解答 解:待测液和氯化钡溶液反应得到沉淀A,则溶液中可能含有CO32-、SO32-、SO42-,向沉淀中加入稀硝酸生成气体,且有部分沉淀不溶解,则溶液中存在CO32-,可能存在SO32-、SO42-中的两种或一种,根据离子共存知,溶液中不存在Ba2+;
滤液A中有Ba2+,加入过量的NaOH溶液得到气体B、白色沉淀B,则溶液中一定含有NH4+、HCO3-,一定不存在Fe3+,气体B为NH3,白色沉淀B为BaCO3,滤液B中通入氯气,得浅黄绿色溶液,溶液中一定没有Br-,滤液B中加入硝酸银、硝酸溶液得到白色沉淀C,C为AgCl,说明滤液B中含有Cl-,由于加入氯化钡溶液,不能确定原溶液中是否含有Cl-;
(1)由上述分析可知,白色沉淀B为碳酸钡,是由HCO3-、Ba2+、OH-反应生成,反应离子方程式为:HCO3-+Ba2++OH-=BaCO3↓+H2O,
故答案为:HCO3-+Ba2++OH-=BaCO3↓+H2O;
(2)由上述分析可知,溶液中一定没有的阳离子是:Fe3+、Ba2+,
故答案为:Fe3+、Ba2+;
(3)由上述分析可知,溶液中一定含有CO32-、HCO3-,不能确定原溶液中是否含有Cl-,溶液中一定没有Br-,
若无色气体D是混合气体,只能为CO2、NO混合气体,白色沉淀D只能为BaSO4,溶液中一定含有SO32-,不能确定是否含有SO42-,沉淀A中一定含有BaCO3,BaSO3,
①待测液中一定含有的阴离子是CO32-、HCO3-、SO32-,
故答案为:CO32-、HCO3-、SO32-;
②沉淀A中BaCO3,BaSO3能与稀硝酸反应,其中能够还原稀硝酸的为BaSO3,
故答案为:BaSO3.
点评 本题考查了离子的推断、检验,熟悉物质的性质是解本题关键,根据实验过程中反应现象、离子共存条件来确定溶液中存在的离子,注意根据溶液中电荷守恒确定钾离子是否存在,同时考查学生综合运用知识解决问题的能力,题目难度较大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成17.6 g硫化亚铁时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ•mol-1 | |
| B. | 稀醋酸与0.1 mol•L-1 NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| D. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则可知C的燃烧热△H=-110.5 kJ•mol-1 |
| A. | 水是弱电解质 | B. | 4℃时,纯水的pH=7 | ||
| C. | 可燃冰是可以燃烧的水 | D. | 氢氧两种元素只能组成水 |
| A. | 酸性高锰酸钾和草酸的反应中,加硫酸锰可大大加快反应速率 | |
| B. | 硫代硫酸钠和硫酸的反应中有硫和二氧化硫产生 | |
| C. | FeCl3和CuSO4都可以做过氧化氢分解的催化剂,且催化效果一样 | |
| D. | H2O2的分解的方程式:2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$ 2H2O+O2↑ |
| A. | 电离平衡常数受溶液浓度的影响 | |
| B. | 电离平衡常数不可以表示弱电解质的相对强弱 | |
| C. | 电离常数越大的酸,其溶液的 c(H+)一定越大 | |
| D. | H2CO3的第一步电离的电离常数表达式:K=$\frac{c({H}^{+})•c(HC{O}_{3}^{-})}{c({H}_{2}C{O}_{3})}$ |
| 主食 | 米饭 |
| 副食 | 红烧肉 清蒸鱼 |
| 饮料 | 牛奶 |
①淀粉 ②蛋白质 ③脂肪
(2)蛋白质水解的最终产物是氨基酸,它的分子中一定含有的官能团是氨基(或-NH2)和羧基(或-COOH).
(3)脂肪在酸性条件下水解的最终产物是高级脂肪酸和甘油(丙三醇)
(4)为使营养均衡,你建议应该增加的食物是①②.
①炒胡萝卜丝 ②水果沙拉 ③可口可乐.
| 实验编号 | c(HA)/mol•L-1 | c(NaOH)/mol•L-1 | 混合液的pH |
| ① | 0.2 | 0.1 | pH>7 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.1 | 0.1 | pH=9 |
| A. | 由实验①可知,HA为弱酸 | |
| B. | 实验①所得混合溶液:c(Na+)>c(A-)>c(OH-)>c(H+) | |
| C. | 实验②所得混合溶液:c(Na+)=c(A-) | |
| D. | 实验③所得混合溶液中由水电离出的OH-的浓度为1×10-9mol•L-1 |
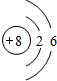 ;
; 已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大.元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同.
已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大.元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同.