题目内容
(9分)下表是某地市场销售的一种“加碘食盐”包装袋上的部分文字说明。
(1)已知碘在碘酸钾中的化合价为+5,1mol碘酸钾中共含5mol原子,则碘酸钾的化学式为____________________________________________________。
(2)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式:
_________+_________KI+_________H2SO4—_________K2SO4+_________I2+_________H2O
(3)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是__________________________。
(4)由食用方法和贮藏指南可推测碘酸钾的化学性质之一是_____________。
(5)用单质碘与氯酸钾发生置换反应可制得碘酸钾,该反应的化学方程式为_____________。
| 配 料 | 氯化钠、碘酸钾 |
| 含碘量 | (20mg~40mg)/1kg |
| 保质期 | 18个月 |
| 食用方法 | 勿长时间炖炒 |
| 贮藏指南 | 避热、防潮 |
(2)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式:
_________+_________KI+_________H2SO4—_________K2SO4+_________I2+_________H2O
(3)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是__________________________。
(4)由食用方法和贮藏指南可推测碘酸钾的化学性质之一是_____________。
(5)用单质碘与氯酸钾发生置换反应可制得碘酸钾,该反应的化学方程式为_____________。
(9分)
(1)KIO3
(2)1KIO3+ 5 KI+ 3 H2SO4= 3 K2SO4+3 I2+ 3 H2O (2分)
(3)a前应检漏;b后应振荡、放气;c前应静置分层(3分)
(4)不稳定,受热易分解
(5)I2+2KClO3=2KIO3+Cl2(2分)
(1)KIO3
(2)1KIO3+ 5 KI+ 3 H2SO4= 3 K2SO4+3 I2+ 3 H2O (2分)
(3)a前应检漏;b后应振荡、放气;c前应静置分层(3分)
(4)不稳定,受热易分解
(5)I2+2KClO3=2KIO3+Cl2(2分)
略

练习册系列答案
相关题目
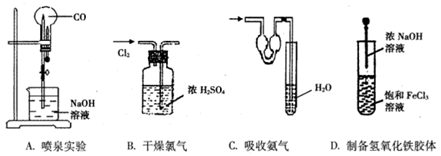
 列实验中所选用的仪器或操作以及结论不合理的是
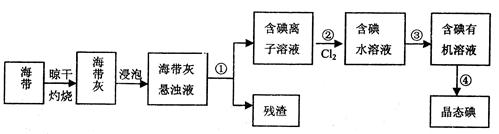
列实验中所选用的仪器或操作以及结论不合理的是  元素,碘元素以碘离子的形式存在。实验室里从海带中提取碘的流程如下图:
元素,碘元素以碘离子的形式存在。实验室里从海带中提取碘的流程如下图: