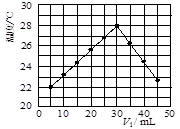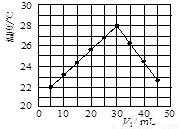��Ŀ����
��12�֣�ij�о�С�齫V1 mL 1.0 mol/L HCl��Һ��V2 mLδ֪Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ��������¼��Һ�¶ȣ�ʵ��������ͼ��ʾ(ʵ����ʼ�ձ���V1��V2��50 mL)���ش��������⣺
��1���о�С������ʵ��ʱ�����¶� (����ڡ���
�����ڡ����ڡ�)22 �棬�жϵ������� ��
(2)����ɼ�ͼ�ο�֪��V1�UV2= ʱ�����ǡ����ȫ�кͣ��˷�Ӧ����NaOH��Һ��Ũ��ӦΪ mol/L��
��3��ʵ��ʱ������ڼ������ȼ��л�ϣ����� ���裬ʹ��Һ��Ͼ��ȡ����йؼ���֪�˷�Ӧ���ų�Q kJ����������д���˷�Ӧ���Ȼ�ѧ����ʽ�� ��
��1�����ڣ�5mLHCl��Һ��45mLNaOH��Һ��Ӧ���Ⱥ���¶��Ѿ���22 �棬����Һ���ǰ��ʵ�黷���¶�һ������22 ��
��2��3�U2��1.5mol��L-1��3�����β����������H+(aq) + OH-(aq)=H2O(aq)��H= -100 Q / 3kJ��mol-1��HCl(aq)+ NaOH(aq)=NaCl(aq)+H2O (l)��H = -100 Q /3 kJ��mol-1��ÿ��2�֣�zx
����:��1������ͼ���֪5mLHCl��Һ��45mLNaOH��Һ��Ӧ���Ⱥ���¶��Ѿ���22 �棬������Һ���ǰ��ʵ�黷���¶�һ������22 �档
��2��ֻ�е�ǡ�÷�Ӧʱ�ų�����������ࡣ��ͼ��֪������������30mlʱ��������࣬���V1�UV2����3�U2�����ݷ�ӦʽH++OH-=H2O����Ӧ����NaOH��Һ��Ũ��ӦΪ![]() mol/L��
mol/L��
��3��Ϊ�˷�ֹ��������ʧ�������ý��������裬��Ӧ�û��β������������Ϊ��Ӧ��ʵ������ˮ0.03mol�����Դ˷�Ӧ���Ȼ�ѧ����ʽΪH+(aq)+ OH-(aq)=H2O (aq)��H = -100 Q / 3 kJ��mol-1��

 ���ѵ����Ԫ��ĩ���100��ϵ�д�
���ѵ����Ԫ��ĩ���100��ϵ�д� ��˼άС�ھ�100����ҵ��ϵ�д�
��˼άС�ھ�100����ҵ��ϵ�д� ��ʦָ��һ��ͨϵ�д�
��ʦָ��һ��ͨϵ�д�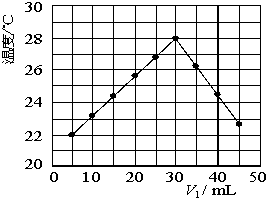 ij�о�С�齫V1 mL 1.0mol/L HCl��Һ��V2 mLδ֪Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ��������¼��Һ�¶ȣ�ʵ��������ͼ��ʾ��ʵ����ʼ�ձ���V1+V2=50mL�����ش��������⣺
ij�о�С�齫V1 mL 1.0mol/L HCl��Һ��V2 mLδ֪Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ��������¼��Һ�¶ȣ�ʵ��������ͼ��ʾ��ʵ����ʼ�ձ���V1+V2=50mL�����ش��������⣺ ij�о�С�齫V1 mL 1.0mol/L HCl��Һ��V2 mLδ֪Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ��������¼��Һ�¶ȣ�ʵ������ͼ��ʾ��ʵ����ʼ�ձ���V1+V2=50mL�����ش��������⣺
ij�о�С�齫V1 mL 1.0mol/L HCl��Һ��V2 mLδ֪Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ��������¼��Һ�¶ȣ�ʵ������ͼ��ʾ��ʵ����ʼ�ձ���V1+V2=50mL�����ش��������⣺