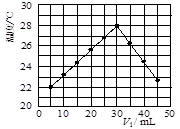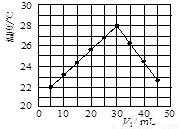题目内容
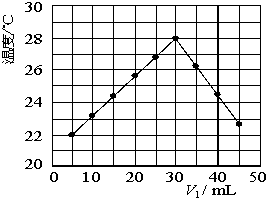 某研究小组将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50mL).回答下列问题:
某研究小组将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50mL).回答下列问题:(1)研究小组做该实验时环境温度
低于
低于
(填“高于”、“低于”或“等于”)22℃,判断的依据是从图型起点可知:5mLHCl溶液和45mLNaOH溶液反应放热后的温度已经是22℃,则溶液混合前的实验环境温度一定低于22℃
从图型起点可知:5mLHCl溶液和45mLNaOH溶液反应放热后的温度已经是22℃,则溶液混合前的实验环境温度一定低于22℃
.(2)由题干及图形可知,V1/V2=
| 3 |
| 2 |
| 3 |
| 2 |
1.5
1.5
mol/L.(3)若通过实验测定及有关计算知此反应共放出Q KJ的热量,请写出此反应的热化学方程式:
H+(aq)+OH-(aq)=H2O (l)△H=-
kJ?mol-1或HCl(aq)+NaOH(aq)=NaCl(aq)+H2O (l)△H=-
kJ?mol-1
| 100Q |
| 3 |
| 100Q |
| 3 |
H+(aq)+OH-(aq)=H2O (l)△H=-
kJ?mol-1或HCl(aq)+NaOH(aq)=NaCl(aq)+H2O (l)△H=-
kJ?mol-1
.| 100Q |
| 3 |
| 100Q |
| 3 |
分析:(1)考虑中和反应是放热反应;
(2)当酸碱恰好反应时,放出的热量最高,从图示可知二者体积比,根据反应关系计算氢氧化钠的浓度;
(3)根据△H=-
计算出△H,根据化学计量数和△H关系写出热化学方程式.
(2)当酸碱恰好反应时,放出的热量最高,从图示可知二者体积比,根据反应关系计算氢氧化钠的浓度;
(3)根据△H=-
| Q |
| n |
解答:解:(1)从图型起点可知:5mLHCl溶液和45mLNaOH溶液反应放热后的温度已经是22℃,则溶液混合前的实验环境温度一定低于22℃,
故答案为:低于;从图型起点可知:5mLHCl溶液和45mLNaOH溶液反应放热后的温度已经是22℃,则溶液混合前的实验环境温度一定低于22℃;
(2)当酸碱恰好反应时,放出的热量最高,从图示可知V1=30mL,V2=50mL-30mL=20mL,二者体积比为:
=
=
,
c(NaOH)=
=
=1.5mol/L.故答案为:
;1.5;
(3)20mL 1.5mol/L氢氧化钠与30mL 1.0mol/L盐酸溶液进行中和反应生成水的物质的量为0.02L×1.50mol/L=0.03mol,
△H=-
KJ/mol=-
KJ/mol,
故答案为:H+(aq)+OH-(aq)=H2O (l)△H=-
kJ?mol-1或HCl(aq)+NaOH(aq)=NaCl(aq)+H2O (l)△H=-
kJ?mol-1.
故答案为:低于;从图型起点可知:5mLHCl溶液和45mLNaOH溶液反应放热后的温度已经是22℃,则溶液混合前的实验环境温度一定低于22℃;
(2)当酸碱恰好反应时,放出的热量最高,从图示可知V1=30mL,V2=50mL-30mL=20mL,二者体积比为:
| V1 |
| V2 |
| 30 |
| 20 |
| 3 |
| 2 |
c(NaOH)=
| c(HCl)×V1 |
| V2 |
| 1.0mol/L×30mL |
| 20mL |
| 3 |
| 2 |
(3)20mL 1.5mol/L氢氧化钠与30mL 1.0mol/L盐酸溶液进行中和反应生成水的物质的量为0.02L×1.50mol/L=0.03mol,
△H=-
| Q |
| 0.03 |
| 100Q |
| 3 |
故答案为:H+(aq)+OH-(aq)=H2O (l)△H=-
| 100Q |
| 3 |
| 100Q |
| 3 |
点评:本题考查了中和热的计算问题,注意从图示得出解题信息是解答本题的关键,并注意中和热的热方程式的书写方法来解答.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
 某研究小组将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).回答下列问题:
某研究小组将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).回答下列问题: