题目内容
0.1 mol/L NaOH溶液140mL与0.1 mol/L H2SO4 60mL充分混合,若混合前后总体积变化忽略不计,则混合后溶液的pH为
| A.2 | B.3 | C.12 | D.14 |
C
解析试题分析:n(OH-)=0.1mol/L×0.14L=0.014mol;n(H+)=0.1mol/L×2×0.06L=0.012mol.由于n(OH-) >n(H+),所以混合后溶液显碱性。n(OH-)(后)= n(OH-)—n(H+)= 0.014mol-0.012mol= 0.002mol.C(OH-) =0.002mol÷0.2L= 0.01mol/L溶液中C(H+)=Kw/C(OH-)=10-14mol2/L2÷10-2mol/L=10-12mol/L.PH=12.故选项为C。
考点:考查酸碱混合溶液的PH的计算方法的知识。

 活力课时同步练习册系列答案
活力课时同步练习册系列答案室温下,向0.1 mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验时不同阶段的溶液,下列有关说法中不正确的是
| A.溶液的pH:a<b<c<d |
| B.溶液的导电能力:a>b>d>c |
| C.a、b溶液呈酸性 |
| D.c、d溶液呈碱性 |
下列有关问题,与盐的水解有关的是
① NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂
② 用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
③ 草木灰与铵态氮肥不能混合施用
④ 实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤ 加热蒸干AlCl3溶液得到Al(OH)3固体
| A.①②③ | B.②③④ | C.①④⑤ | D.①②③④⑤ |
物质的量浓度相同的下列溶液中,NH4+浓度最大的是
| A.NH4Cl | B.NH4HCO3 | C.CH3COONH4 | D.NH4HSO4 |
下列物质的水溶液, pH>7的是
| A.NH4HSO4 | B.NaHCO3 | C.K2SO4 | D.FeCl3 |
室温下将等物质的量的NaCN和HCN溶于一定量水中,再加入适量稀盐酸,调整溶液pH=7。下列说法正确的是( )
| A.未加入稀盐酸之前:c(HCN)>c(Na+)>c( CN-) >c(OH-)>c(H+) |
| B.加稀盐酸后溶液中c(CN-)+c(HCN)= c(Na+) |
| C.pH=7时,溶液中:c( Na+)=" c(" CN-) |
| D.加稀盐酸后H2O的电离程度减小 |
将常温下pH=12的氢氧化钠溶液与pH=2的硫酸溶液分别加热,溶液pH的变化是
| A.前者减小后者不变 | B.前者减小后者增大 | C.都不变 | D.都减小 |
有4种混合溶液,分别由等体积0.1mol/L的2种溶液混合而成: ①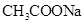 与
与 ②
② 与NaOH ③
与NaOH ③ 与
与 ④
④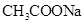 与
与 ,下列各项排序正确的是
,下列各项排序正确的是
| A.pH:②>③>④>① | B. :②>④>③>① :②>④>③>① |
| C.溶液中c(H+): ①>③>②>④ | D. : ①>④>③>② : ①>④>③>② |