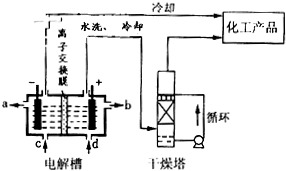
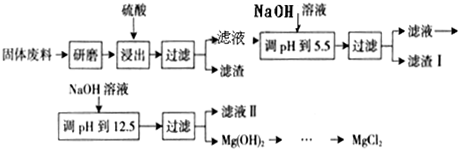
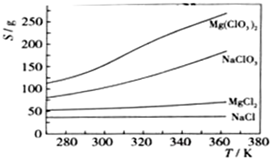
题目内容
T℃时,某NaOH溶液中c(H+)=10-amol?L-1,c(OH-)=10-bmol?L-1,已知a+b=12.向该溶液中逐滴加入pH=c的盐酸(T℃),测得混合溶液的部分pH如表中所示:
假设溶液混合前后的体积变化忽略不计,则c为( )
| 序号 | NaOH溶液的体积/mL | 盐酸的体积mL | 溶液的pH |
| ① | 20.00 | 0.00 | 8 |
| ② | 20.00 | 20.00 | 6 |
分析:已知a+b=12,某NaOH溶液中kw=c(H+).c(OH-)=10-amol?L-1.10-bmol?L-1=10-12,当盐酸的体积为0时,测定溶液的PH是氢氧化钠溶液的pH,则溶液中c(OH-)=
mol/L=10-4 mol/L,当两种溶液等体积混合时,根据混合溶液的pH计算酸的浓度,从而得出盐酸溶液的pH.
| 10-12 |
| 10-8 |
解答:解:已知a+b=12,某NaOH溶液中kw=c(H+).c(OH-)=10-amol?L-1.10-bmol?L-1=10-12,当盐酸的体积为0时,测定溶液的PH是氢氧化钠溶液的pH,则溶液中c(OH-)=
mol/L=10-4 mol/L;
当两种溶液等体积混合时,溶液的pH=6,结合水的离子积常数知,该溶液呈中性,则酸和碱的物质的量相等,
两溶液的体积相等,则c(HCl)=c(NaOH)=10-4 mol/L,所以盐酸的pH=4,
故选B.
| 10-12 |
| 10-8 |
当两种溶液等体积混合时,溶液的pH=6,结合水的离子积常数知,该溶液呈中性,则酸和碱的物质的量相等,
两溶液的体积相等,则c(HCl)=c(NaOH)=10-4 mol/L,所以盐酸的pH=4,
故选B.
点评:本题考查酸碱混合溶液定性判断,灵活运用水的离子积常数是解本题关键,注意此温度下水的离子积常数不是10-14,为易错点.

练习册系列答案
 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案
相关题目


 NH3?H2O
NH3?H2O NH4++OH-,NaOH溶于水电离出OH-,使平衡向左移动,且溶解时放出热量,使NH3的溶解度减小
NH4++OH-,NaOH溶于水电离出OH-,使平衡向左移动,且溶解时放出热量,使NH3的溶解度减小