题目内容
(2011?上海模拟)某反应体系中有物质:Bi2(SO4)3、NaMnO4、H2O、MnSO4、NaBiO3、Na2SO4、H2SO4.
(1)请将NaBiO3之外的反应物与生成物分别填入以下空格内.

(2)反应中,被氧化的元素是
(3)将氧化剂与还原剂及其已配平的化学计量数填入下列空格中,并标出电子转移的方向和数目.

(1)请将NaBiO3之外的反应物与生成物分别填入以下空格内.

(2)反应中,被氧化的元素是
正二价的锰元素
正二价的锰元素
,氧化剂是NaBiO3
NaBiO3
.(3)将氧化剂与还原剂及其已配平的化学计量数填入下列空格中,并标出电子转移的方向和数目.

分析:(1)根据化合价的升降判断参加氧化还原反应的反应物和生成物,然后根据元素守恒判断未参加氧化还原反应的反应物和生成物.
(2)根据化合价的升降判断被氧化的元素、氧化剂;
(3)根据化合价 的升降判断电子的转移方向,根据得失电子的最小公倍数确定转移的电子数.
(2)根据化合价的升降判断被氧化的元素、氧化剂;
(3)根据化合价 的升降判断电子的转移方向,根据得失电子的最小公倍数确定转移的电子数.
解答:解:(1)该反应中NaBiO3是反应物,根据Bi元素守恒,Bi2(SO4)3是生成物,Bi元素由反应物到生成物,化合价降低,所以NaBiO3是氧化剂;NaMnO4中锰元素的化合价是+7价,MnSO4中锰元素的化合价是+2价,要选取还原剂,只能是化合价由低变高,所以MnSO4作还原剂,NaMnO4是氧化产物;再根据元素守恒,反应物中还有硫酸,产物中还有Na2SO4和H2O.
故答案为:NaBiO3+MnSO4+H2SO4→Bi2(SO4)3+NaMnO4+Na2SO4+H2O.
(2)该反应中,锰元素由+2价失电子变为+7价,所以二价锰元素被氧化;通过(1)分析知,NaBiO3是氧化剂.
故答案为:正二价的锰元素; NaBiO3.
(3)该反应中,NaBiO3是氧化剂,MnSO4作还原剂;MnSO4→NaMnO4,锰元素由+2价→+7价,一个MnSO4失去5个电子;NaBiO3→Bi2(SO4)3,Bi元素由+5价→+3价,生成一个Bi2(SO4)3,需得4个电子,所以其得失电子的最小公倍数为20.
故答案为: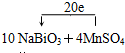
故答案为:NaBiO3+MnSO4+H2SO4→Bi2(SO4)3+NaMnO4+Na2SO4+H2O.
(2)该反应中,锰元素由+2价失电子变为+7价,所以二价锰元素被氧化;通过(1)分析知,NaBiO3是氧化剂.
故答案为:正二价的锰元素; NaBiO3.
(3)该反应中,NaBiO3是氧化剂,MnSO4作还原剂;MnSO4→NaMnO4,锰元素由+2价→+7价,一个MnSO4失去5个电子;NaBiO3→Bi2(SO4)3,Bi元素由+5价→+3价,生成一个Bi2(SO4)3,需得4个电子,所以其得失电子的最小公倍数为20.
故答案为:
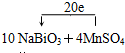
点评:本题考查了氧化还原反应的配平,要依据氧化还原反应中得失电子数相等进行配平.

练习册系列答案
相关题目
