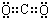题目内容
17.下列说法中不正确的是( )| A. | 等质量的N2和CO含有相同数目的原子 | |
| B. | 1mol臭氧和1.5mol氧气含有相同的氧原子数 | |
| C. | 1mol氧气中含有12.04×1023个氧原子,在常温常压下占有体积22.4L | |
| D. | 等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比为1:6,氧原子数之比为1:3 |
分析 根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$结合物质的构成计算相关物理量,注意常温常压下Vm≠22.4L/mol.
解答 解:A.N2和CO的相对原子质量都为28,且都为双原子分子,则等质量的N2和CO含有相同数目的原子,故A正确;
B.1mol臭氧和1.5mol氧气都含有3mol氧原子,故B正确;
C.注意常温常压下Vm≠22.4L/mol,故C错误;
D.干冰分子式为CO2,等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比为1:6,氧原子数之比为1:3,故D正确.
故选C.
点评 本题考查物质的量的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握相关物理量的计算以及气体摩尔体积等知识,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8. 汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题.
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题.
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图:则该反应的热化学方程式为N2(g)+O2(g)=2NO(g)△H=+183 kJ/moL.
(2)一氧化碳是一种用途相当广泛的化工基础原料.可以还原金属氧化物,还可以用来合成很多有机物如甲醇等.在压强为0.1MPa条件下,将amolCO与3amolH2的混合气体在催化剂作用下反应生成甲醇:
CO(g)+2H2(g)?CH3OH(g)△H=-bkJ•mol-1
①该反应的平衡常数表达式为$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$.
②若容器容积不变,下列措施可增加甲醇产率的是BD.
A.升高温度 B.将CH3OH(g)从体系中分离 C.充入He,使体系总压强增大D.再充入1molCO和3molH2
③经测定不同温度下该反应的平衡常数如下:
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)=0.4mol•L-1、c(H2)=0.4mol•L-1、c(CH3OH)=0.8mol•L-1,则此时v正<v逆(填“>”、“<”或“=”).
(3)甲醇是重要的基础化工原料,又是一种新型的燃料,最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.该电池的负极反应式为CH3OH+3O2--6e-═CO2+2H2O.电池工作时,固体电解质里的O2-向负极移动.
 汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题.
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题.(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图:则该反应的热化学方程式为N2(g)+O2(g)=2NO(g)△H=+183 kJ/moL.
(2)一氧化碳是一种用途相当广泛的化工基础原料.可以还原金属氧化物,还可以用来合成很多有机物如甲醇等.在压强为0.1MPa条件下,将amolCO与3amolH2的混合气体在催化剂作用下反应生成甲醇:
CO(g)+2H2(g)?CH3OH(g)△H=-bkJ•mol-1
①该反应的平衡常数表达式为$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$.
②若容器容积不变,下列措施可增加甲醇产率的是BD.
A.升高温度 B.将CH3OH(g)从体系中分离 C.充入He,使体系总压强增大D.再充入1molCO和3molH2
③经测定不同温度下该反应的平衡常数如下:
| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
(3)甲醇是重要的基础化工原料,又是一种新型的燃料,最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.该电池的负极反应式为CH3OH+3O2--6e-═CO2+2H2O.电池工作时,固体电解质里的O2-向负极移动.
2.如图所示是分离混合物时常用的仪器,从左至右,说法错误的是( )


| A. | 仪器C是圆底烧瓶,加热时,液体量不超过容积的$\frac{2}{3}$,不少于容积的$\frac{1}{3}$ | |
| B. | 仪器b是直型冷凝管 | |
| C. | 仪器b中冷却水的进出方向是“下进上出” | |
| D. | 进行蒸馏操作时,温度计的下端不能放在液面以下 |
6.下列离子方程式不正确的是( )
| A. | FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O | |
| B. | 向碳酸氢钙溶液中加入过量氢氧化钠 Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| C. | 用铁棒作阴极、炭棒作阳极电解饱和氯化钠溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| D. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++Al3++2SO42-+4OH-═AlO2-+2BaSO4↓+2H2O |
7.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 标准状况下,11.2LCCl4中含有分子的数目为0.5NA | |
| B. | 标准状况下,2.24LCl2通入水中生成NA个HClO | |
| C. | 1.6gO2与O3组成的混合物中所含O原子数为0.1NA | |
| D. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA |