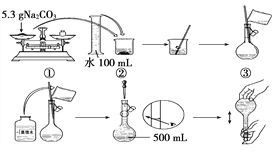
题目内容
【题目】有关物质的量的计算是中学化学的重要内容,完成以下填空:
(1)0.5 L 1 mol/L CaCl2溶液中Ca2+的物质的量为_______,Cl的物质的量浓度为_______。
(2)标准状况下,33.6 L的HCl所具有的物质的量为______,将其溶解于水配成3 L的溶液,所得盐酸的物质的量浓度为______。
(3)8 g NaOH溶于______g水中,才能使每10个水分子中溶有一个钠离子。
(4)49 g H2SO4中含______mol原子,含______个质子。
(5)标准状况下,2.4 g某气体的体积为672 mL,则此气体的相对分子质量为_______。
(6)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为_____。
【答案】0.5 mol 2 mol/L 1.5 mol 0.5 mol/L 36 3.5 25NA 80 48.3%
【解析】
(1)钙离子的物质的量=0.5 L×1 mol/L=0.5 mol,氯化钙中氯离子浓度与氯化钙浓度之比为2∶1,氯化钙的浓度是1 mol/L,则氯离子的浓度是2 mol/L。
(2)n=![]() =
=![]() =1.5 mol,c=
=1.5 mol,c=![]() =
=![]() =0.5 mol/L。
=0.5 mol/L。
(3)n(NaOH)=![]() =0.2 mol,要使每10个水分子中溶有一个钠离子,则水的物质的量与氢氧化钠的物质的量之比为10∶1,水的质量m=nM=0.2 mol×10×18 g/mol=36 g。
=0.2 mol,要使每10个水分子中溶有一个钠离子,则水的物质的量与氢氧化钠的物质的量之比为10∶1,水的质量m=nM=0.2 mol×10×18 g/mol=36 g。
(4)49 g H2SO4的物质的量为![]() =0.5 mol,含原子0.5 mol×7=3.5 mol,含质子0.5 mol×(16+8×4+1×2)=25 mol,数目为25NA。
=0.5 mol,含原子0.5 mol×7=3.5 mol,含质子0.5 mol×(16+8×4+1×2)=25 mol,数目为25NA。
(5)标准状况下,672 mL气体的物质的量为![]() =0.03 mol,该气体的摩尔质量=
=0.03 mol,该气体的摩尔质量=![]() =
=![]() =80 g/mol,则此气体的相对分子质量为80。
=80 g/mol,则此气体的相对分子质量为80。
(6)三种混合气体的平均相对分子质量为14.5×2=29,因CO与N2的相对分子质量相同,求算平均相对分子质量时可一并考虑,设混合气体的总物质的量为1 mol,其中O2的物质的量为x mol,则CO和N2的物质的量之和为(1x) mol,因此有:32x+28(1x)=29×1,解得x=0.25,CO和N2的物质的量之比为1∶1,设混合气体为1 mol,则混合气体中氧元素的物质的量为:0.25 mol×2+(0.75 mol÷2)×1=0.875 mol,氧元素的质量分数为![]() ×100%=48.3%。
×100%=48.3%。

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案