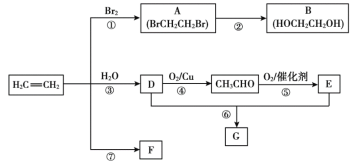
题目内容
【题目】硼、碳、镓、砷、硒的化合物被广泛应用于新材料制备、生活生产等诸多领域。根据物质结构相关知识,回答下列问题:
(1)第四周期镓、砷、硒三种元素中,第一电离能由大到小顺序为___,电负性由大到小顺序为___(用元素符号填写)
(2)元素氮与砷同族。基态氮元素的价电子排布式为___,预测砷的氢化物分子的立体结构为___,其沸点比NH3的___(填“高”或“低”),其判断理由是___。
(3)硼及化合物应用广泛。已知BP的熔点很高,其晶胞结构如图所示。
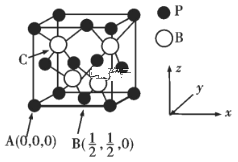
C点的原子坐标为___,B原子与P原子的最近距离为dpm,晶体的密度为pg/cm3,NA代表阿伏加德罗常数的值,则ρ=___g/cm3(用含d、NA的代数式表示)
【答案】As>Se>Ga Se>As>Ga 2s22p3 三角锥形 低 NH3分子间存在氢键 (![]() ,
,![]() ,
,![]() )
) 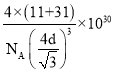
【解析】
(1)同周期元素的第一电离能随原子序数的增大而增大,砷最外层电子处于半充满状态,则第一电离能大于其后的元素;同周期元素的电负性随原子序数的增大而增大;
(2)砷化氢与氨气为等电子体;氨气分子间存在氢键,而砷化氢分子间无氢键;
(3)根据ρ=m/V计算。
(1)第四周期镓、砷、硒分别为IIIA族、VA族、VIA族元素,同周期元素的第一电离能随原子序数的增大而增大,砷最外层电子处于半充满状态,则第一电离能大于其后的元素,则第一电离能由大到小的顺序为As>Se>Ga;同周期元素的电负性随原子序数的增大而增大,则电负性由大到小顺序为Se>As>Ga;
(2)氮元素位于第二周期VA族元素,则基态氮元素的价电子排布式为2s22p3;砷化氢与氨气为等电子体,氨气为三角锥形,则砷化氢为三角锥形;砷化氢的沸点比氨气低,氨气分子间存在氢键,使分子间的作用力增大,熔沸点升高,而砷化氢分子间无氢键;
(3)C点在顶点与顶点所在的3个面的面心上的P原子构成的正四面体的中心,则C点的坐标为(![]() ,
,![]() ,
,![]() );一个晶胞中含有P的个数=8×
);一个晶胞中含有P的个数=8×![]() +6×
+6×![]() =4,B原子在晶胞的体内,个数为4,根据晶胞的结构,B原子与P原子的最近距离为体对角线的1/4,体对角线=4dpm,棱长=
=4,B原子在晶胞的体内,个数为4,根据晶胞的结构,B原子与P原子的最近距离为体对角线的1/4,体对角线=4dpm,棱长=![]() pm,则ρ=m/V=(11+31)×4/
pm,则ρ=m/V=(11+31)×4/![]() =
=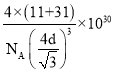 g/cm3。
g/cm3。