题目内容
【题目】[2016·新课标I]元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、![]() (绿色)、
(绿色)、![]() (橙红色)、
(橙红色)、![]() (黄色)等形式存在。Cr(OH)3为难溶于水的灰蓝色固体。回答下列问题:
(黄色)等形式存在。Cr(OH)3为难溶于水的灰蓝色固体。回答下列问题:
(1)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是 。
(2)![]() 和
和![]() 在溶液中可相互转化。室温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(
在溶液中可相互转化。室温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(![]() )随c(H+)的变化如图所示。
)随c(H+)的变化如图所示。

①用离子方程式表示Na2CrO4溶液中的转化反应 。
②由图可知,溶液酸性增大,![]() 的平衡转化率 (填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为 。
的平衡转化率 (填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为 。
③升高温度,溶液中![]() 的平衡转化率减小,则该反应的ΔH 0(填“大于”“小于”或“等于”)。
的平衡转化率减小,则该反应的ΔH 0(填“大于”“小于”或“等于”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl,利用Ag+与![]() 生成砖红色沉淀,指示到达滴定终点。当溶液中Cl恰好沉淀完全(浓度等于1.0×105 mol·L1)时,溶液中c(Ag+)为___________mol·L1,此时溶液中c(
生成砖红色沉淀,指示到达滴定终点。当溶液中Cl恰好沉淀完全(浓度等于1.0×105 mol·L1)时,溶液中c(Ag+)为___________mol·L1,此时溶液中c(![]() )等于 mol·L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
)等于 mol·L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的![]() 还原成Cr3+,该反应的离子方程式为 。
还原成Cr3+,该反应的离子方程式为 。
【答案】(1)蓝紫色溶液变浅,同时有灰蓝色沉淀生成,然后沉淀逐渐溶解形成绿色溶液
(2)①2![]() +2H+
+2H+![]()
![]() +H2O ②增大 1.0×1014 ③小于
+H2O ②增大 1.0×1014 ③小于
(3)2.0×105 5.0×103
(4) ![]() +3
+3![]() +5H+
+5H+![]() 2Cr3++3
2Cr3++3![]() +4H2O
+4H2O
【解析】本题以铬及其化合物为载体,考查化学反应原理,涉及化学反应与现象、化学平衡原理、反应热、溶度积计算以及陌生离子方程式的书写,意在考查考生的综合运用能力、知识迁移和新信息处理能力以及识图能力。(1)根据题意可知,在硫酸铬溶液中逐滴加入氢氧化钠溶液时,首先发生反应:Cr3++3OH![]() Cr(OH)3↓,蓝紫色溶液逐渐变浅,同时产生灰蓝色沉淀,当氢氧化钠溶液过量时,灰蓝色沉淀逐渐溶解,发生反应:Cr(OH)3+OH
Cr(OH)3↓,蓝紫色溶液逐渐变浅,同时产生灰蓝色沉淀,当氢氧化钠溶液过量时,灰蓝色沉淀逐渐溶解,发生反应:Cr(OH)3+OH![]()
![]() ,最终得到绿色溶液。
,最终得到绿色溶液。
(2)①从图象看出,铬酸根离子在酸性条件下逐渐转化成重铬酸根离子,离子方程式为2![]() +2H+
+2H+![]()
![]() +H2O。②从图象看出,酸性越强,c(
+H2O。②从图象看出,酸性越强,c(![]() )越大,说明
)越大,说明![]() 的平衡转化率越大。A点对应的离子浓度:c(
的平衡转化率越大。A点对应的离子浓度:c(![]() )=0.25 mol·L1,c(H+)=1.0×107mol·L1。c(
)=0.25 mol·L1,c(H+)=1.0×107mol·L1。c(![]() )=1.0 mol·L10.25 mol·L1×2=0.5 mol·L1。平衡常数K=
)=1.0 mol·L10.25 mol·L1×2=0.5 mol·L1。平衡常数K=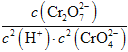 =
=![]() =1.0×1014。③升高温度,
=1.0×1014。③升高温度,![]() 的平衡转化率减小,说明平衡向左移动,根据平衡移动原理,正反应是放热反应,ΔH<0。
的平衡转化率减小,说明平衡向左移动,根据平衡移动原理,正反应是放热反应,ΔH<0。
(3)根据溶度积计算:c(Ag+)=![]() =
=![]() mol·L1=2.0×105 mol·L1,故c(
mol·L1=2.0×105 mol·L1,故c(![]() )=
)=![]() =
=![]() mol·L1=5.0×103 mol·L1。
mol·L1=5.0×103 mol·L1。
(4)根据题意,氧化剂是![]() ,还原剂是
,还原剂是![]() ,氧化产物是
,氧化产物是![]() ,还原产物是Cr3+。根据得失电子守恒、电荷守恒和原子守恒配平离子方程式:
,还原产物是Cr3+。根据得失电子守恒、电荷守恒和原子守恒配平离子方程式: ![]() +3
+3![]() +5H+
+5H+![]() 2Cr3++3
2Cr3++3![]() +4H2O。
+4H2O。




