题目内容
【题目】在500℃、2×107 Pa和催化剂条件下合成氨工业的核心反应是:N2(g)+3H2(g)2NH3(g)△H=QkJmol﹣1 . 反应过程中能量变化如图所示,回答下列问题: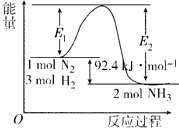
(1)在500℃、2×107Pa和催化剂条件下向一密闭容器中充入0.5mol N2和1.5mol H2 , 充分反应后,放出的热量(填“<”“>”或“=”)46.2kJ,理由是 .
(2)将一定量的H2(g)和N2(g)放入1L密闭容器中,在500℃、2×107 Pa下达到平衡,测得N2为0.10mol,H2为0.30mol,NH3为0.10mol.则该条件下达到平衡时H2的转化率为 . 该温度下的平衡常数K的值为 . 若升高温度,K值(填“增大”“减小”或“不变”).
【答案】
(1)<;此反应为可逆反应,0.5 mol N2和1.5 mol H2不可能完全反应
(2)33.3%;![]() ;减小
;减小
【解析】解:(1)由图可知,1mol N2和3mol H2完全反应放出热量为92.4kJ,此反应为可逆反应,0.5 mol N2和1.5mol H2不可能完全反应,充分反应后,放出的热量<46.2kJ,所以答案是:<;此反应为可逆反应,0.5 mol N2和1.5mol H2不可能完全反应;(2)将一定量的H2(g)和N2(g)放入1L密闭容器中,在500℃、2×107 Pa下达到平衡,测得N2为0.10mol,H2为0.30mol,NH3为0.10mol,则: N2(g)+3H2(g)2NH3(g)
起始量(mol):0.15 0.450
变化量(mol):0.05 0.150.1
平衡量(mol):0.1 0.30.1
氢气转化率= ![]() ×100%=33.3%;
×100%=33.3%;
平衡常数K= ![]() =
= ![]() =
= ![]() ;正反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,所以答案是:33.3%;
;正反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,所以答案是:33.3%; ![]() ;减小.
;减小.
【考点精析】认真审题,首先需要了解化学平衡状态本质及特征(化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)),还要掌握化学平衡的计算(反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%)的相关知识才是答题的关键.

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案