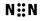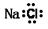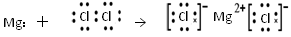题目内容
(7分)甲是一种盐,由A、B、C、D、E五种元素组成,其中四种是短周期元素。甲溶于水后可电离出三种离子,其中含有由A、B形成的五核10电子阳离子。A元素原子核内质子数比E的少1,D、E处于同主族。用甲进行如下实验:
①取少量甲的晶体溶于蒸馏水配成溶液;
②取少量甲溶液于试管中滴入KSCN溶液,无现象,再滴入氯水,溶液呈红色;
③取少量甲溶液于试管中加入适量NaOH溶液,加热;
④取少量甲溶液于试管中,向其中加入稀盐酸,无明显现象,再加入BaCl2溶液,出现白色沉淀。
回答下列问题:
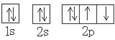
(1)C的元素符号是 ,D的原子结构示意图 。
(2)用离子方程式表示实验②中现象的原因:
(3)实验③中出现的现象是 。
(4)经测定甲晶体的摩尔质量为392 g/mol,其中阳离子与阴离子物质的量之比为3:2,则甲晶体的化学式为 。
①取少量甲的晶体溶于蒸馏水配成溶液;
②取少量甲溶液于试管中滴入KSCN溶液,无现象,再滴入氯水,溶液呈红色;
③取少量甲溶液于试管中加入适量NaOH溶液,加热;
④取少量甲溶液于试管中,向其中加入稀盐酸,无明显现象,再加入BaCl2溶液,出现白色沉淀。
回答下列问题:
(1)C的元素符号是 ,D的原子结构示意图 。
(2)用离子方程式表示实验②中现象的原因:
(3)实验③中出现的现象是 。
(4)经测定甲晶体的摩尔质量为392 g/mol,其中阳离子与阴离子物质的量之比为3:2,则甲晶体的化学式为 。
( 7分)(1)Fe 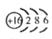
(2)2Fe2++Cl2===2Cl-+2Fe3+ Fe3++3SCN-=Fe(SCN)3
(3)有白色絮状沉淀生成,迅速变成灰绿色,最终变成红褐色,加热有大量刺激性气味的气体生成(或有能使湿润的红色石蕊试纸变蓝的气体生成)。
(4)(NH4)2Fe(SO4)2·6H2O [或Fe(NH4)2(SO4)2·6H2O]
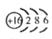
(2)2Fe2++Cl2===2Cl-+2Fe3+ Fe3++3SCN-=Fe(SCN)3
(3)有白色絮状沉淀生成,迅速变成灰绿色,最终变成红褐色,加热有大量刺激性气味的气体生成(或有能使湿润的红色石蕊试纸变蓝的气体生成)。
(4)(NH4)2Fe(SO4)2·6H2O [或Fe(NH4)2(SO4)2·6H2O]
A、B形成的五核10电子阳离子,所以A是N,B是H,则E是O。根据实验②可知,含有亚铁离子。根据实验④可知,含有SO42-。又因为D、E处于同主族,实验D是S,C是Fe。
(1)S的质子数是16,所以原子结构示意图是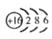 。
。
亚铁离子能被氯气氧化生成铁离子,而铁离子能和KSCN溶液反应,反应的方程式分别是2Fe2++Cl2===2Cl-+2Fe3+ 、Fe3++3SCN-=Fe(SCN)3。
(3)由于含有NH4+和Fe2+,所以加入氢氧化钠并加热后的实验现象是有白色絮状沉淀生成,迅速变成灰绿色,最终变成红褐色,加热有大量刺激性气味的气体生成(或有能使湿润的红色石蕊试纸变蓝的气体生成)。
(4)根据以上分析可知,阴离子是SO42-,阳离子是NH4+和Fe2+,所以根据电荷守恒可知,NH4+和Fe2+的个数之比是2︰1。其中含有的结晶水是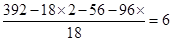 ,因此化学式是(NH4)2Fe(SO4)2·6H2O。
,因此化学式是(NH4)2Fe(SO4)2·6H2O。
(1)S的质子数是16,所以原子结构示意图是
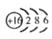 。
。亚铁离子能被氯气氧化生成铁离子,而铁离子能和KSCN溶液反应,反应的方程式分别是2Fe2++Cl2===2Cl-+2Fe3+ 、Fe3++3SCN-=Fe(SCN)3。
(3)由于含有NH4+和Fe2+,所以加入氢氧化钠并加热后的实验现象是有白色絮状沉淀生成,迅速变成灰绿色,最终变成红褐色,加热有大量刺激性气味的气体生成(或有能使湿润的红色石蕊试纸变蓝的气体生成)。
(4)根据以上分析可知,阴离子是SO42-,阳离子是NH4+和Fe2+,所以根据电荷守恒可知,NH4+和Fe2+的个数之比是2︰1。其中含有的结晶水是
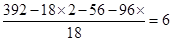 ,因此化学式是(NH4)2Fe(SO4)2·6H2O。
,因此化学式是(NH4)2Fe(SO4)2·6H2O。
练习册系列答案
相关题目