题目内容
已知反应:①101 kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221 kJ/mol;②稀溶液中,
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol。下列结论正确的是( )
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol。下列结论正确的是( )
| A.稀硫酸与稀NaOH溶液的中和热为57.3 kJ/mol |
| B.①的反应热为221 kJ/mol |
| C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
A
中和热是指在一定条件下的稀溶液中酸和碱反应生成1mol水时所放出的热量,
A正确。燃烧热是指在一定条件下,可燃物完全燃烧生成稳定的氧化物时所放出的热量,C完全燃烧的产物是CO2,B不正确。中和反应一定是放热反应,在表述其中和热时不要带负号,C不正确。醋酸是弱酸,在反应过程中会继续电离,而电离是吸热的,所以稀醋酸与稀NaOH溶液反应生成1 mol水,放出热量应小于57.3 kJ,D不正确。
A正确。燃烧热是指在一定条件下,可燃物完全燃烧生成稳定的氧化物时所放出的热量,C完全燃烧的产物是CO2,B不正确。中和反应一定是放热反应,在表述其中和热时不要带负号,C不正确。醋酸是弱酸,在反应过程中会继续电离,而电离是吸热的,所以稀醋酸与稀NaOH溶液反应生成1 mol水,放出热量应小于57.3 kJ,D不正确。

练习册系列答案
相关题目
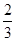 c(Na+)= c(HCO3—)+ c(CO32—)+ c(H2CO3)
c(Na+)= c(HCO3—)+ c(CO32—)+ c(H2CO3)
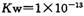 ,下列叙述正确的是
,下列叙述正确的是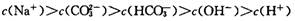
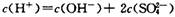
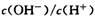 随之增大
随之增大