题目内容
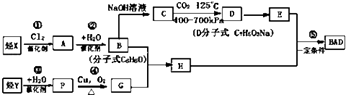
【题目】物质A﹣G有下图所示转化关系(部分反应物、生成物没有列出).其中A为某金属矿的主要成分,经过一系列反应可得到B和C.单质C可与E的浓溶液发生反应,G为砖红色沉淀. 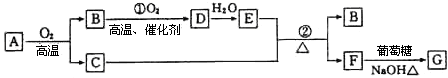
请回答下列问题:
(1)写出下列物质的化学式:B、G;
(2)C与硫磺在加热条件下的生成物与足量浓硝酸反应的离子方程式为: .
(3)反应②的化学方程式是;
(4)将0.23molB和0.11mol氧气放入容积为1L的密闭容器中,发生反应①,在一定温度下,反应达到平衡,得到0.12molD,则反应的平衡常数K= . 若温度不变,再加入0.50mol氧气后重新达到平衡,D的体积分数(填“增大”、“不变”或“减小”)
【答案】
(1)SO2;Cu2O
(2)Cu2S+12H++10NO3﹣═2Cu2++SO42﹣+10NO2↑+2H2O
(3)Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(4)23.8 mol﹣1?L;减小
【解析】解:F与葡萄糖/NaOH在加热条件下反应生成G为砖红色沉淀,则G为Cu2O,F为铜盐,A为某金属矿物的主要成分,与氧气反应得到C与B,B氧化得到D,D与水反应得到E,单质C可与E的浓溶液发生反应得到B与F,则A为Cu2S、B为SO2、C为Cu,D为SO3、E为H2SO4 , F为CuSO4 .
(1.)由上述分析可知,B为SO2 , G为Cu2O,所以答案是:SO2;Cu2O;
(2.)C与硫磺在加热条件下的生成物为Cu2S,Cu2S与足量浓硝酸反应的离子方程式为:Cu2S+12H++10NO3﹣═2Cu2++SO42﹣+10NO2↑+2H2O,所以答案是:Cu2S+12H++10NO3﹣═2Cu2++SO42﹣+10NO2↑+2H2O;
(3.)反应②的化学方程式是:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O,所以答案是:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,所以答案是:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(4.)将0.23molSO2和0.11mol氧气放入容积为1L的密闭容器中,发生反应①,在一定温度下,反应达到平衡,得到0.12molSO3 , 则:
2SO2(g) | + | O2 (g) |
| 2SO3(g) | |
起始(mol/L): | 0.23 | 0.11 | 0 | ||
转化(mol/L): | 0.12 | 0.06 | 0.12 | ||
平衡2(mol/L): | 0.11 | 0.05 | 0.12 |
则反应的平衡常数K= ![]() =23.8 mol﹣1L,
=23.8 mol﹣1L,
第一次平衡时SO3的体积分数为: ![]() =0.429,
=0.429,
可逆反应中任意物质的浓度不可能为零的特点,设又减小的氧气浓度为xmol/L,可得关系式: ![]() ,解得x<0.055,所以第二次平衡时SO3的体积分数最大为:
,解得x<0.055,所以第二次平衡时SO3的体积分数最大为: ![]() =0.313,SO3体积分数减小了,
=0.313,SO3体积分数减小了,
所以答案是:23.8 mol﹣1L;减小.

 学业测评一课一测系列答案
学业测评一课一测系列答案