题目内容
(15分)铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)单质铁属于______晶体,将FeCl3溶液加热蒸干,灼烧所得的物质是______ (填化学式):
(2)请写出铝与氢氧化钠溶液反应的化学方程式______________________________
(3)金属Cu单独与氨水或单独与双氧水都不反应,但可与二者的混合溶液反应生成深蓝色溶液,在该深蓝色的浓溶液中加入乙醇所产生的现象是______,画出呈深蓝色的离子的结构式______.
写出Cu与氨水、双氧水反应的离子方程式:____________________________________.
(4)在硫酸亚铁溶液中加入过量的碳酸氢铵,有FeCO3沉淀生成,写出其化学方程式____________.
(1)金属晶体(1分),Fe2O3(2分)[来源:学。科。网Z。X。X。K]
(2)2Al+2NaOH+2H2O=2NaAlO2+3H2↑(3分)
(3)析出深蓝色晶体(1分) 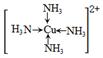 (2分)
(2分)
Cu+4NH3·H2O+H2O2=[Cu(NH3)4]2++4H2O+2OH-(3分)
(4)FeSO4+2NH4HCO3=FeCO3↓+CO2↑+(NH4)2SO4+H2O(3分)
解析试题分析:(1)单质铁属于金属晶体,FeCl3溶液存在Fe3+ + 3H2O  Fe(OH)3 + 3H+,加热蒸干促进水解生成氢氧化铁沉淀、灼烧氢氧化铁分解得Fe2O3;(2)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;(3)金属Cu与双氧水发生氧化还原反应,生成的铜离子随即与一水合氨中的氮形成配位键,这种离子化合在乙醇中溶解度小而析出深蓝色晶体,其结构为
Fe(OH)3 + 3H+,加热蒸干促进水解生成氢氧化铁沉淀、灼烧氢氧化铁分解得Fe2O3;(2)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;(3)金属Cu与双氧水发生氧化还原反应,生成的铜离子随即与一水合氨中的氮形成配位键,这种离子化合在乙醇中溶解度小而析出深蓝色晶体,其结构为 ,离子方程式是Cu+4NH3?H2O+H2O2=[Cu(NH3)4]2++4H2O+2OH-;(4)在硫酸亚铁溶液中加入过量的碳酸氢铵,有FeCO3沉淀生成,同时碳酸氢根离子电离出的氢离子与碳酸氢根离子结合成二氧化碳和水,化学方程式为FeSO4+2NH4HCO3=FeCO3↓+CO2↑+(NH4)2SO4+H2O。
,离子方程式是Cu+4NH3?H2O+H2O2=[Cu(NH3)4]2++4H2O+2OH-;(4)在硫酸亚铁溶液中加入过量的碳酸氢铵,有FeCO3沉淀生成,同时碳酸氢根离子电离出的氢离子与碳酸氢根离子结合成二氧化碳和水,化学方程式为FeSO4+2NH4HCO3=FeCO3↓+CO2↑+(NH4)2SO4+H2O。
考点:考查晶体结构的判断、盐类水解的应用、配位化合物及化学方程式的书写。

关于晶体的叙述中,正确的是
| A.原子晶体中,共价键的键能越大,熔、沸点越高 |
| B.分子晶体中,分子间的作用力越大,该分子越稳定 |
| C.分子晶体中,共价键的键能越大,熔、沸点越高 |
| D.某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体 |
某化学式为AB的离子晶体,已知5r(A2+)=4r(B2-)(各类离子晶体与 关系如下图所示),经测定其密度为
关系如下图所示),经测定其密度为 g·cm-3,其摩尔质量为Mg·mol-1,则下列有关该晶体的说法正确的是( )
g·cm-3,其摩尔质量为Mg·mol-1,则下列有关该晶体的说法正确的是( )
| r+/r- | 配位数 | 实例 |
| 0.225~0.414 | 4 | ZnS |
| 0.414~0.732 | 6 | NaCl |
| 0.732~1.0 | 8 | CsCl |
| >1.0 | 12 | CsF |
A.该晶体结构与ZnS晶体相似
B.该晶体每个晶胞中有2个A2+和B2-
C.该晶体晶胞的边长为
 cm
cmD.A2+离子紧邻的B2-构成的空间结构为立方体
下列各项中,理由、结论及因果关系均正确的是
| 选项 | 理由 | 结论 |
| A | 键能:N≡N>Cl-Cl | 单质沸点:N2>Cl2 |
| B | 分子中可电离的H+个数:H2SO4>CH3COOH | 酸性:H2SO4>CH3COOH |
| C | 元素的非金属性:N>P | 酸性:HNO3>H3PO4 |
| D | 氧化性:Fe3+>Cu2+ | 还原性:Fe2+>Cu |
已知反应A+B=C+D的能量变化如右图所示,下列说法正确的是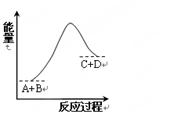
| A.该反应为放热反应 |
| B.该反应为吸热反应 |
| C.反应物的总能量高于生成物的总能量 |
| D.该反应只有在加热条件下才能进行 |
下列关于能源和作为能源的物质的叙述错误的是
| A.吸热反应的反应物总能量低于生成物总能量 |
| B.绿色植物进行光合作用时,将光能转化为化学能“贮存”起来 |
| C.物质的化学能可以在不同条件下转为热能、电能、光能等为人类所利用 |
| D.天然气属于二次能源 |
