题目内容
等物质的量的NaHCO3和KHCO3的混合物9.20 g与100 mL盐酸反应。
(1)试分析,欲求标准状况下生成的CO2的体积时,还需什么数据(用a、b等表示,要注明单位)。
(2)求标准状况下生成的CO2的体积。
| 所需数据的取值范围 | 生成CO2的体积(标准状况) |
| 盐酸不足时 | |
| 盐酸恰好反应时 | |
| 盐酸过量时 |
(3)若NaHCO3和KHCO3不是等物质的量混合,则9.20 g固体与盐酸完全反应时,在标准状况下生成CO2气体的体积范围___________________________。
(1)a mol·L-1 (2)2.24a L 2.24 L 2.24 L (3)2.06 L<V(CO2)<2.45 L
解析:
(1)由H++![]() ====H2O+CO2↑可知,欲求标准状况下的CO2气体的体积,需确定
====H2O+CO2↑可知,欲求标准状况下的CO2气体的体积,需确定![]() 与H+过量与否,显然缺少的数据为盐酸的物质的量浓度,设为a mol·L-1。
与H+过量与否,显然缺少的数据为盐酸的物质的量浓度,设为a mol·L-1。
(2)当H+与![]() 恰好完全反应时:
恰好完全反应时:
0.1 L ·a mol·L-1=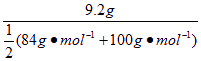 a=1 mol·L-1;若盐酸不足,则a<1 mol·L-1,产生的CO2的体积按HCl的物质的量计算:V(CO2)=2.24a L;若盐酸过量,则a>1 mol·L-1产生的CO2的物质的量等于混合物的物质的量,V(CO2)=2.24 L。
a=1 mol·L-1;若盐酸不足,则a<1 mol·L-1,产生的CO2的体积按HCl的物质的量计算:V(CO2)=2.24a L;若盐酸过量,则a>1 mol·L-1产生的CO2的物质的量等于混合物的物质的量,V(CO2)=2.24 L。
(3)盐酸足量,混合物完全反应。若9.2 g全部为NaHCO3,则产生的CO2体积:V(CO2)=![]() ×22.4 L·mol-1=2.45 L;若9.2 g全部为KHCO3,则产生的CO2体积:V(CO2)=
×22.4 L·mol-1=2.45 L;若9.2 g全部为KHCO3,则产生的CO2体积:V(CO2)=![]() ×22.4 L·mol-1=2.06 L。若9.2 g为两者混合物时,则有:2.06 L<V(CO2)<2.45 L。
×22.4 L·mol-1=2.06 L。若9.2 g为两者混合物时,则有:2.06 L<V(CO2)<2.45 L。

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
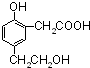 ,用等物质的量的该有机物分别与Na、NaOH、NaHCO3反应时,则消耗Na、NaOH、NaHCO3的物质的量之比为( )
,用等物质的量的该有机物分别与Na、NaOH、NaHCO3反应时,则消耗Na、NaOH、NaHCO3的物质的量之比为( ) ,下列说法正确的是
,下列说法正确的是 SO2Cl2(l)△H=-97.3kJ?mol-1
SO2Cl2(l)△H=-97.3kJ?mol-1 是一种会产生温室效应的气体,等物质够量的
是一种会产生温室效应的气体,等物质够量的 产生的温室效应,前者大,下面有关天然气的几种叙述中正确的是
产生的温室效应,前者大,下面有关天然气的几种叙述中正确的是 是一种会产生温室效应的气体,等物质够量的
是一种会产生温室效应的气体,等物质够量的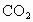 产生的温室效应,前者大,下面有关天然气的几种叙述中正确的是
产生的温室效应,前者大,下面有关天然气的几种叙述中正确的是