题目内容
一定温度下,在2L的密闭容器中,X、 Y、Z三种气体的物质的量随时间变化的曲线如下图所示:
下列描述正确的是
| A.反应开始到10s,用Z表示的反应速率为0.158 mol/(L·s)-1 |
| B.反应开始到l0s,X的物质的量浓度减少了0.79 mol/L |
| C.反应开始到10S时,Y的转化率为79.0% |
D.反应的化学方程式为:X(g)+Y(g) Z(g) Z(g) |
C
解析试题分析:A、根据图像可知,反应进行到10s时,Z的物质的量增加了1.58mol,其浓度是1.58mol÷2L=0.79mol/L,则反应开始到10s,用Z表示的反应速率=0.79mol/L÷10s=0.079mol/(L·s)-1,A不正确;B、反应开始到l0s时,X的物质的量减少了1.20mol-0.41mol=0.79mol,其浓度是0.79mol÷2L=0.395mol/L,B不正确;C、反应进行到10s时,Y的物质的量减少了1.00mol-0.21mol=0.79mol,则Y的转化率= ×100%=79%,C正确;D、由于物质的量变化量之比等于相应的化学计量数之比,则化学计量数之比=0.79:0.79:1.58=1:1:2,所以该反应的化学方程式为X(g)+Y(g)
×100%=79%,C正确;D、由于物质的量变化量之比等于相应的化学计量数之比,则化学计量数之比=0.79:0.79:1.58=1:1:2,所以该反应的化学方程式为X(g)+Y(g) 2Z(g),D不正确,答案选C。
2Z(g),D不正确,答案选C。
考点:考查反应速率的有关计算、可逆反应方程式的书写

 阅读快车系列答案
阅读快车系列答案下列说法不正确的是:
| A.能量较高、有可能发生有效碰撞的分子称为活化分子 |
| B.活化分子的平均能量与所有分子的平均能量之差称为活化能 |
| C.催化剂能参与反应,可降低原反应所需活化能 |
| D.非活化分子也有可能发生有效碰撞 |
在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:A(s)+2B(g) C(g)+D(g)已达到平衡状态( )
C(g)+D(g)已达到平衡状态( )
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④气体的总物质的量
⑤混合气体总质量
| A.②③⑤ | B.①②③ | C.②③④ | D.①③④⑤ |
某温度下,反应X(g)+3Y(g) 2Z(g)的平衡常数为1 600。此温度下,在容积一定的密闭容器中加入一定量的X和Y,反应到某时刻测得各组分的浓度如下:
2Z(g)的平衡常数为1 600。此温度下,在容积一定的密闭容器中加入一定量的X和Y,反应到某时刻测得各组分的浓度如下:
下列说法正确的是( )
| A.此时v(正)<v(逆) |
| B.平衡时Y的浓度为0.05 mol·L-1 |
| C.平衡时X的转化率为40% |
| D.增大压强使平衡向正反应方向移动,平衡常数增大 |
一定条件下,在密闭容器中,能表示反应X(g)+2Y(g) 2Z(g)一定达到化学平衡状态的是( )。
2Z(g)一定达到化学平衡状态的是( )。
①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y
| A.①② | B.①④ | C.②③ | D.③④ |
在一定温度下,饱和氯水中存在平衡:Cl2+H2O H++Cl-+HClO。下列说法中正确的是( )
H++Cl-+HClO。下列说法中正确的是( )
| A.光照一段时间后,c(HClO)减小 |
| B.加入碳酸钙粉末后,溶液的pH增大,可以提高HClO浓度 |
| C.加入少量水,由水电离的c(H+)减小 |
D.加入少量NaOH固体,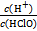 增大 增大 |
 2C(g) △H<0,下列各图中正确的是
2C(g) △H<0,下列各图中正确的是
 2C(g) △H<0,下列各图中正确的是
2C(g) △H<0,下列各图中正确的是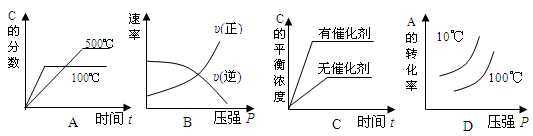

 2C(g)在2L密闭容器中反应,0.5min内C的物质的量增加了0.6mol有关反应速率中正确的是 ( )
2C(g)在2L密闭容器中反应,0.5min内C的物质的量增加了0.6mol有关反应速率中正确的是 ( )