题目内容
把6 mol A气体和5 mol B气体混合放入3A(g)+B(g)![]()
A.x=2 B.B的转化率为20%
C.平均时A的浓度为0.8 mol·L-1 D.恒温达平衡时容器内压强为开始时的85%
解析:本题是一道有关化学平衡的基础计算题,解题的关键是弄清各量的含义。
因n(D)=v(D)·V·t=0.1 mol·L-1·min-1×
n(C)∶n(D)=2 mol∶2 mol=1∶1,所以x=2
3A(g)+B(g)![]() 2C(g)+2D(g)
2C(g)+2D(g)
起始量(mol) 6 5 0 0
变化量(mol) 3 1 2 2
平衡量(mol) 3 4 2 2
B的转化率为:![]() ×100%=
×100%=![]() ×100%=20%
×100%=20%
平衡时A的浓度:![]() =0.75 mol·L-1
=0.75 mol·L-1
![]() =1
=1
所以P平=P始
答案:CD

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
 2C(g)+xD(g),经5min达到平衡,此时生成2 mol C,测得D的平均反应速率为0.15 mol/(L·min),则平衡时A的物质的量浓度是____________;B的转化率是__________;x的值是___________。
2C(g)+xD(g),经5min达到平衡,此时生成2 mol C,测得D的平均反应速率为0.15 mol/(L·min),则平衡时A的物质的量浓度是____________;B的转化率是__________;x的值是___________。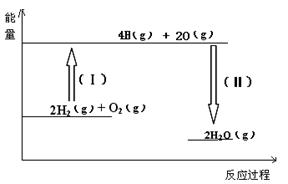
 2C(g)+xD(g),经5min达到平衡,此时生成2 mol C,测得D的平均反应速率为0.15 mol/(L·min),则平衡时A的物质的量浓度是____________;B的转化率是__________;x的值是___________。
2C(g)+xD(g),经5min达到平衡,此时生成2 mol C,测得D的平均反应速率为0.15 mol/(L·min),则平衡时A的物质的量浓度是____________;B的转化率是__________;x的值是___________。
