题目内容
【题目】A﹣I是中学化学常见的九种物质,A﹣I之间的转化关系如图所示. 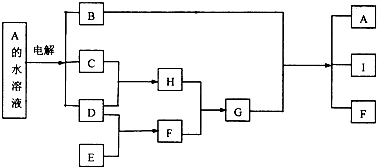
已知化合物A的焰色反应显黄色,C、D、E是气态单质,F、H是气态化合物,两者在通常状况下反应产生大量白烟.请回答下列问题:
(1)写出I的电子式;
(2)写出电解A溶液的离子反应方程式;
(3)以F、空气和水为原料经过一系列的化学反应可以合成酸M,M的浓溶液与铜反应产生红棕色气体,写出M的浓溶液与铜反应的化学方程式 .
(4)G的溶液可使Mg(OH)2悬浊液溶解.若Mg(OH)2饱和溶液中的c(Mg2+)=0.18mol/L,则溶液的pH是 . (已知:Ksp[Mg(OH)2]=1.8×10﹣11mol/L)
【答案】
(1)![]()
(2)2Cl﹣+2H2O ![]() Cl2↑+H2↑+2OH﹣
Cl2↑+H2↑+2OH﹣
(3)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
(4)9
【解析】解:化合物A的焰色反应显黄色,C、D、E是气态单质,A电解生成C、D,所以A应为NaCl,所以B为NaOH,C、D为Cl2和H2 , C和D反应生成H为HCl,F、H在通常状况下反应产生大量白烟,则F是NH3 , G为NH4Cl,氢氧化钠与氯化铵反应生成I为H2O,E和D反应生成F,所以E为N2 , 以NH3、空气和水为原料经过一系列的化学反应可以合成酸M为HNO3。
(1.)I为H2O,I的电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;
;
(2.)电解NaCl溶液的离子反应方程式为 2Cl﹣+2H2O ![]() Cl2↑+H2↑+2OH﹣ ,
Cl2↑+H2↑+2OH﹣ ,
所以答案是:2Cl﹣+2H2O ![]() Cl2↑+H2↑+2OH﹣;
Cl2↑+H2↑+2OH﹣;
(3.)M为HNO3 , M的浓溶液与铜反应的化学方程式为Cu+4HNO3 (浓)=Cu(NO3)2+2NO2↑+2H2O,所以答案是:Cu+4HNO3 (浓)=Cu(NO3)2+2NO2↑+2H2O;(4)Mg(OH)2饱和溶液中的c(OH﹣)= ![]() =
= ![]() mol/L=1×10﹣5 mol/L,则溶液的pH是9,所以答案是:9.
mol/L=1×10﹣5 mol/L,则溶液的pH是9,所以答案是:9.

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案