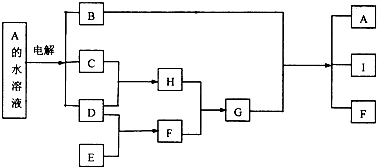
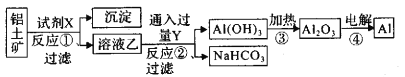
题目内容
【题目】实验室用如图所示装置制取溴化亚铁.D和d中均盛有液溴,E为外套电炉丝的瓷管,e是两只耐高温的瓷皿,其中共盛有56g细铁粉.实验开始时先将干燥、纯净的CO2气流通入D中,然后将铁粉加热至600℃~700℃,E管中反应开始.E中的反应为:
2Fe+3Br2═2FeBr3 , 2FeBr3 ![]() 2FeBr2+Br2↑,
2FeBr2+Br2↑,
最后将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁80g.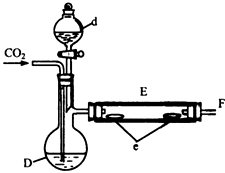
请回答:
(1)仪器d的名称 .
(2)导入的CO2不干燥,会在E中发生副反应,其含铁副产物为;若所得产物中含此副产物,用化学方法检验.下列方案合理的是 .
A.取少量产物于试管中加入稀盐酸,再加入KSCN溶液
B.取少量产物于硬质大试管中,通入氢气,排尽空气后加热,用CuSO4检验生成的水蒸气
C.用磁铁吸引,看产物能否被吸引
D.取少量产物于试管中加入蒸馏水,过滤看是否有黑色不溶物
(3)为防止污染空气,实验时应在F处连接盛有NaOH溶液的尾气吸收装置,反应的化学方程式: .
(4)取产品10g配制成250mL溶液,取出25.00mL用酸性KMnO4溶液滴定溶液中的Fe2+ , 用去0.03000mol/L酸性KMnO4溶液25.00mL,则产品的纯度为 .
(5)利用除去杂质后的FeBr2可以验证Cl2、Fe3+、Br2的氧化性强弱.将你设计的实验操作、预计的实验现象和实验结论(氧化性强弱)填写在下列表空格内:
实验操作 | 实验现象 | 氧化性强弱 |
① | 溶液呈血红色 | ② |
③ | ④ | Cl2>Br2 |
【答案】
(1)分液漏斗
(2)Fe3O4;B
(3)2NaOH+Br2=NaBr+NaBrO+H2O
(4)81%
(5)①取一定量FeBr2溶于水,加入少量(或几滴)氯水(或通入少量氯气),加入KSCN溶液.;②Cl2>Fe3+;③取少量FeBr2溶于水,加入过量氯水(或通入足量氯气),加入四氯化碳,震荡.;④四氯化碳层呈棕红色
【解析】解:(1.)根据装置图可知仪器d的名称为分液漏斗,所以答案是:分液漏斗;
(2.)铁与水蒸气反应生成四氧化三铁和氢气,所以含铁副产物为Fe3O4;
A.产物中含有FeBr3 , 取少量产物于试管中加入稀盐酸,再加入KSCN溶液,溶液呈血红色,不能说明含有铁的氧化物,故A错误;
B.取少量产物于硬质大试管中,通入氢气,排尽空气后加热,用CuSO4检验生成的水蒸气,说明产物中含有铁的氧化物,故B正确;
C.铁单质也能被磁化而被磁铁吸引,所以产物能被吸引不一定是四氧化三铁,故C错误;
D.细铁粉也是黑色不溶物,所以取少量产物于试管中加入蒸馏水,过滤有黑色不溶物不一定是铁的氧化物,故D错误,故选B,所以答案是:Fe3O4;B;
(3.)氢氧化钠溶液能吸收溴,生成次溴酸钠和溴化钠,反应方程式为2NaOH+Br2=NaBr+NaBrO+H2O,所以答案是:2NaOH+Br2=NaBr+NaBrO+H2O;
(4.)根据电子得失守恒有关系式KMnO4~5Fe2+ , 反应中用去KMnO4的物质的量为0.025L×0.03000mol/L=7.5×10﹣4mol,所以10g样品中含有FeBr2的物质的量为7.5×10﹣4mol× ![]() ×5=0.0375mol,所以样品中FeBr2的纯度为
×5=0.0375mol,所以样品中FeBr2的纯度为 ![]() ×100%=81%,
×100%=81%,
所以答案是:81%;
(5.)验证Cl2、Fe3+、Br2的氧化性强弱的操作为:取一定量FeBr2溶于水,加入少量(或几滴)氯水(或通入少量氯气),加入KSCN溶液,若溶液呈血红色,则说明氧化性Cl2>Fe3+、Br2>Fe3+;取少量FeBr2溶于水,加入过量氯水(或通入足量氯气),加入四氯化碳,震荡,若四氯化碳层呈棕红色,则说明氧化性Cl2>Br2 ,
所以答案是:
实验操作 | 实验现象 | 氧化性强弱 |
①取一定量FeBr2溶于水,加入少量(或几滴)氯水(或通入少量氯气),加入KSCN溶液. | ②Cl2>Fe3+ | |
③取少量FeBr2溶于水,加入过量氯水(或通入足量氯气),加入四氯化碳,震荡. | ④四氯化碳层呈棕红色 |

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案【题目】硝酸是氧化性酸,其本质是NO3﹣有氧化性,某课外实验小组进行了下列有关NO3﹣氧化性的探究(实验均在通风橱中完成).
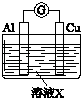
实验装置 | 编号 | 溶液X | 实验现象 |
| 实验Ⅰ | 6molL﹣1稀硝酸 | 电流计指针向右偏转,铜片表面产生无色气体,在液面上方变为红棕色. |
实验Ⅱ | 15molL﹣1浓硝酸 | 电流计指针先向右偏转,很快又偏向左边,铝片和铜片表面产生红棕色气体,溶液变为绿色. |
(1)实验Ⅰ中,铝片作(填“正”或“负”)极.液面上方产生红棕色气体的化学方程式是 .
(2)实验Ⅱ中电流计指针先偏向右边后偏向左边的原因是 .
查阅资料:活泼金属与1molL﹣1稀硝酸反应有H2和NH4+生成,NH4+生成的原理是产生H2的过程中NO3﹣被还原.
(3)用如图装置进行实验Ⅲ:溶液X为1molL﹣1稀硝酸溶液,观察到电流计指针向右偏转.
①反应后的溶液中含NH4+ . 实验室检验NH4+的方法是 .
②生成NH4+的电极反应式是 .
(4)进一步探究碱性条件下NO3﹣的氧化性,进行实验Ⅳ: 
①观察到A中有NH3生成,B中无明显现象.A、B产生不同现象的解释是 .
②A中生成NH3的离子方程式是 .
(5)将铝粉加入到NaNO3溶液中无明显现象,结合实验Ⅲ和Ⅳ说明理由 .