题目内容
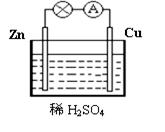
(9分)(1)X、Y、Z、W四种金属片进入稀盐酸中,用导线连接,可以组成原电池,实验结果如下图所示,则四种金属的活泼性由强到弱的顺序为______ _____

(2)假设第一个装置中两个金属片一个是铝片一个是铜片,电解质溶液是盐酸,请写出两极的电极反应式:正极 、负极
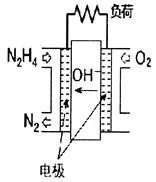
(3)用KOH溶液做电解质溶液的氢氧燃料电池的正极反应式

(2)假设第一个装置中两个金属片一个是铝片一个是铜片,电解质溶液是盐酸,请写出两极的电极反应式:正极 、负极
(3)用KOH溶液做电解质溶液的氢氧燃料电池的正极反应式
(1) Z〉Y〉X〉W 3分
(2)正极: 6H+ + 6e- =3H2↑ 2分负极: 2Al- 6e- =2Al3+ 2分
(3)正极: O2 + 4 e- + 2H2O = 4OH- 2分
(2)正极: 6H+ + 6e- =3H2↑ 2分负极: 2Al- 6e- =2Al3+ 2分
(3)正极: O2 + 4 e- + 2H2O = 4OH- 2分
考查原电池的应用及电极反应式的书写。
(1)在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。所以根据第1个可知Z的金属性强于Y的,第2个可知Y的金属性强于X的,第3个可知Z强于W的,第4个可知X强于W的,所以四种金属的活泼性由强到弱的顺序为Z〉Y〉X〉W。
(2)铝比铜活泼,铝是负极,铜是正极,电极反应式分别是2Al- 6e- =2Al3+、6H+ + 6e- =3H2↑。
(3)氢氧燃料电池中氧气在正极通入,所以反应式为O2 + 4 e- + 2H2O = 4OH-。
(1)在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。所以根据第1个可知Z的金属性强于Y的,第2个可知Y的金属性强于X的,第3个可知Z强于W的,第4个可知X强于W的,所以四种金属的活泼性由强到弱的顺序为Z〉Y〉X〉W。
(2)铝比铜活泼,铝是负极,铜是正极,电极反应式分别是2Al- 6e- =2Al3+、6H+ + 6e- =3H2↑。
(3)氢氧燃料电池中氧气在正极通入,所以反应式为O2 + 4 e- + 2H2O = 4OH-。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目