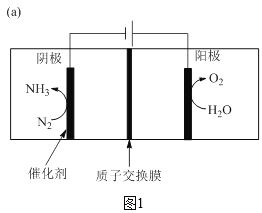
题目内容
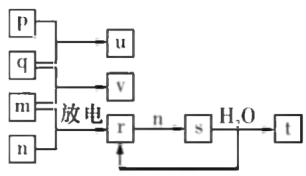
【题目】氢气作为清洁能源有着广泛的应用前景,含硫天然气制备氢气的流程如图。

请回答下列问题:
Ⅰ.转化脱硫:将天然气压入吸收塔,30℃时,在T·F菌作用下,酸性环境中脱硫过程示意图如图。
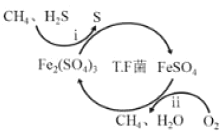
过程i的离子反应方程式为_____。
已知:①Fe3+在pH=1.9时开始沉淀,pH=3.2时沉淀完全。
②30℃时,在T·F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如表。
pH | 0.7 | 1.1 | 1.5 | 1.9 | 2.3 | 2.7 |
Fe2+的氧化速率 | 4.5 | 5.3 | 6.2 | 6.8 | 7.0 | 6.6 |
在转化脱硫中,请在表中选择最佳pH范围是____<pH<____,这样选择的原因是:______。
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合如图回答问题。
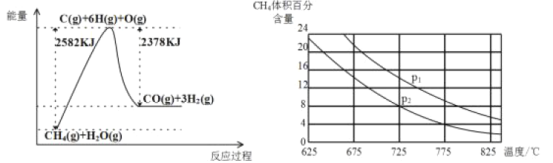
(3)①该过程的热化学方程式是_____。
②比较压强P1和P2的大小关系:P1____P2(选填“<”、“>”或“=”)。
Ⅲ.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
Ⅳ.提纯:将CO2和H2分离得到H2的过程如示意图如图。
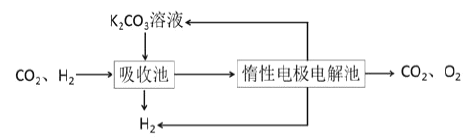
(4)吸收池中发生反应的离子方程式是______。
【答案】2Fe3++H2S=2Fe2++S↓+2H+ 1.5 1.9 当pH>1.9时,Fe3+开始沉淀,导致Fe2+、Fe3+离子浓度均下降,降低反应速率;当pH<1.5时,T·F菌活性降低,反应速率减慢 CH4(g)+H2O(g)=CO(g)+3H2(g) H=+204kJ/mol > CO2+H2O+CO32-=2HCO3-
【解析】
I.转化脱硫:将天然气压入吸收塔,30℃时,在T.F菌作用下,酸性环境中脱硫过程示意图如图;
(1)硫化氢被硫酸铁氧化生成单质硫;
(2)1.5≤PH<1.9,当PH大于1.9时,Fe3+开始沉淀,导致Fe3+、Fe2+离子浓度均下降,降低反应速率,PH<1.5时,TF菌活性较低;
Ⅱ.(3)①在催化剂的作用下,水蒸气将CH4氧化生成一氧化碳和水蒸气,图中反应的焓变△H=2582KJ/mol-2378KJ/mol=204KJ/mol,标注物质聚集状态和对应反应的焓变写出热化学方程式;
②图象中甲烷体积分数随压强增大增大,据此分析;
Ⅳ.(4)二氧化碳和碳酸钾溶液反应生成碳酸氢钾。
I.转化脱硫:将天然气压入吸收塔,30℃时,在T.F菌作用下,酸性环境中脱硫过程示意图如图;
(1)硫化氢被硫酸铁氧化生成单质硫,过程i中H2S发生了氧化反应,离子方程式:2Fe3++H2S=2Fe2++S↓+2H+;
(2)Fe3+在pH=l.9时开始沉淀,pH=3.2时沉淀完全,分析30℃时,在T.F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率可知:工业脱硫应选择的最佳pH范围1.5≤PH<1.9,当PH大于1.9时,Fe3+开始沉淀,导致Fe3+、Fe2+离子浓度均下降,降低反应速率,PH<1.5时,TF菌活性较低,反应速率减慢;
Ⅱ.(3)①在催化剂的作用下,水蒸气将CH4氧化生成一氧化碳和水蒸气,图中反应的焓变△H=2582KJ/mol-2378KJ/mol=204KJ/mol,标注物质聚集状态和对应反应的焓变写出热化学方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+204KJ/mol;
②反应前后气体物质的量增大,增大压强平衡逆向进行,图象中甲烷体积分数随压强增大而增大,据此分析,比较压强P1和P2的大小关系:P1>P2;
Ⅳ.(4)①将CO2和H2分离得到H2的过程示意图分析得到:二氧化碳和碳酸钾溶液反应生成碳酸氢钾,反应的离子方程式为CO2+H2O+CO32-=2HCO3-。

 名校课堂系列答案
名校课堂系列答案