题目内容
已知33As、35Br位于同一周期。某反应中反应物与生成物有以下几种:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是 。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式是 。
(3)在该反应条件下可推知 (填序号)。
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
(4)将该反应方程式配平后,氧化剂和还原剂的物质的量之比为 ,其中1 mol KBrO3得到电子的物质的量为 mol。
(1)AsH3 (2)Br2 (3)ac (4)8∶5 5
解析

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
RO2受热分解为+4和+2价的混合氧化物,+4价的R能氧化浓盐酸生成Cl2,现将1mol RO2加热分解得到O2,再向残余固体中加入过量的浓盐酸得到Cl2,所得 O2和Cl2物质的量之比为3 : 2,则残余固体的组成及物质的量之比可能是
| A.R3O4,RO,2 :1 | B.RO2,RO, 1:3 |
| C.RO2,R3O4 ,1 : 2 | D.RO2,RO,1 : 4 |
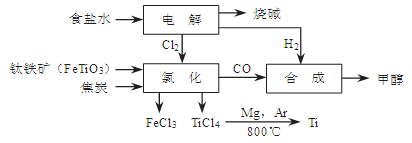
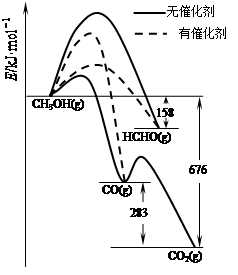
 CH3OH(g)。
CH3OH(g)。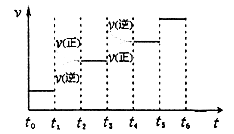
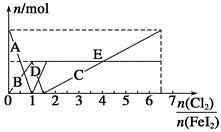
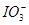 、Fe2+、Fe3+等粒子的物质的量随n(Cl2)∶n(FeI2)变化的曲线如图所示。
、Fe2+、Fe3+等粒子的物质的量随n(Cl2)∶n(FeI2)变化的曲线如图所示。