题目内容
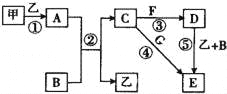
【题目】(1)实验室制取、净化并收集氯气涉及以下几个主要阶段:

现有以下2种试剂: A.饱和食盐水 B.NaOH溶液
请在以上试剂中选择填空(填“A”或“B”):
①写出上述制取氯气的离子方程式_____________________,X溶液应选用______。
②尾气处理过程中,多余的氯气可用______吸收,写出该过程的离子方程式_____。

(2)FeSO47H2O受热分解的化学方程式为:2FeSO47H2O ![]() Fe2O3+SO2↑+SO3↑+14 H2O
Fe2O3+SO2↑+SO3↑+14 H2O
请回答:
① FeSO47H2O俗名叫________矾,将其受热产生的气体按图示装置进行实验,证实含有SO3和SO2。 能说明SO2存在的实验现象是________;为测定BaSO4沉淀的质量,后续的操作步骤依次为________、洗涤、干燥、称重。
②设计一个实验方案,用化学方法验证FeSO4受热后固体的成分(不考虑其他反应)_______________。
【答案】 MnO2+2Cl-+4H+![]() Mn2++Cl2↑+2H2O A B Cl2+2OH-=Cl-+ClO-+H2O 绿 品红溶液褪色 过滤 取适量固体,加足量的稀盐酸溶解,分成两份,一份中滴加KSCN溶液,若是血红色,则有Fe3+,说明含有Fe2O3 ;另外一份滴加BaCl2溶液,若有白色沉淀,则有SO42- ,说明含有未分解的FeSO4
Mn2++Cl2↑+2H2O A B Cl2+2OH-=Cl-+ClO-+H2O 绿 品红溶液褪色 过滤 取适量固体,加足量的稀盐酸溶解,分成两份,一份中滴加KSCN溶液,若是血红色,则有Fe3+,说明含有Fe2O3 ;另外一份滴加BaCl2溶液,若有白色沉淀,则有SO42- ,说明含有未分解的FeSO4
【解析】(1)由题意知,实验室制取、净化并收集氯气涉及以下几个主要阶段:首先用二氧化锰和浓盐酸加热制氯气,接着依次通过饱和食盐水和浓硫酸除去氯气中的杂质HCl和水蒸气,然后收集氯气,最后是尾气处理。 ①上述制取氯气的离子方程式为MnO2+2Cl-+4H+![]() Mn2++Cl2↑+2H2O,X溶液应选用饱和食盐水,选A。②尾气处理过程中,多余的氯气可用NaOH溶液吸收,选B ,该过程的离子方程式Cl2+2OH-=Cl-+ClO-+H2O。
Mn2++Cl2↑+2H2O,X溶液应选用饱和食盐水,选A。②尾气处理过程中,多余的氯气可用NaOH溶液吸收,选B ,该过程的离子方程式Cl2+2OH-=Cl-+ClO-+H2O。
(2)FeSO47H2O受热分解的化学方程式为:2FeSO47H2O ![]() Fe2O3+SO2↑+SO3↑+14 H2O。① FeSO47H2O俗名叫绿矾,将其受热产生的气体按图示装置进行实验,证实含有SO3和SO2。 能说明SO2存在的实验现象是品红溶液褪色;为测定BaSO4沉淀的质量,后续的操作步骤依次为过滤、洗涤、干燥、称重。
Fe2O3+SO2↑+SO3↑+14 H2O。① FeSO47H2O俗名叫绿矾,将其受热产生的气体按图示装置进行实验,证实含有SO3和SO2。 能说明SO2存在的实验现象是品红溶液褪色;为测定BaSO4沉淀的质量,后续的操作步骤依次为过滤、洗涤、干燥、称重。
②根据题中信息可知, FeSO4受热后所得固体中有氧化铁和可能未完全分解的FeSO4,可以设计如下实验验证其成分: 取适量固体,加足量的稀盐酸溶解,分成两份,一份中滴加KSCN溶液,若溶液变为血红色,则有Fe3+,说明含有Fe2O3 ;另外一份滴加BaCl2溶液,若有白色沉淀,则有SO42- ,说明含有未分解的FeSO4。

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案