题目内容
【题目】根据问题填空:
(1)下列原子: ![]() C、147N、
C、147N、 ![]() Na、
Na、 ![]() H、
H、 ![]() U、
U、 ![]() K、
K、 ![]() U中共有种元素,种核素,和互为同位素.
U中共有种元素,种核素,和互为同位素.
(2)下列曲线分别表示元素的某种性质与核电荷数的关系(X为核电荷数,Y为元素的 有关性质).把与下面元素有关的性质相符的曲线标号填入相应的空格中: 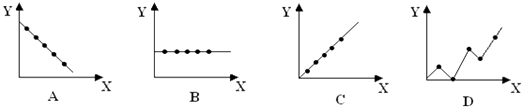
② 第ⅡA族元素的最外层电子数;
②第三周期元素的最高化合价;
③碱金属单质的熔点
(3)阴离子的中子数为N:AXn﹣共有x个电子,则N= .
(4)有下列物质中NH3、Na2O、CO2、CaCl2、CCl4、N2、NaHCO3、NaOH、Na2O2、NH4Cl属于电解质的有 .
【答案】
(1)6;7; ![]() U;
U; ![]() U
U
(2)B;C;A
(3)A﹣x+n
(4)6个
【解析】解:(1)原子:: ![]() C、147N、
C、147N、 ![]() Na、
Na、 ![]() H、
H、 ![]() U、
U、 ![]() K、
K、 ![]() U质子数都92,属于同一元素,所以共有6种元素,具有一定数目质子和一定数目中子的一种原子叫做核素,所以共有7种核素,原子AZX,中子数(N)=质量数(Z)﹣质子数(A),
U质子数都92,属于同一元素,所以共有6种元素,具有一定数目质子和一定数目中子的一种原子叫做核素,所以共有7种核素,原子AZX,中子数(N)=质量数(Z)﹣质子数(A), ![]() U、
U、 ![]() U质子数都92,中子数不同,属于同位素,
U质子数都92,中子数不同,属于同位素,
所以答案是:6、7、 ![]() U、
U、 ![]() U;(1)6、7、
U;(1)6、7、 ![]() U、
U、 ![]() U(2)①ⅡA族元素的最外层电子数相等,图象B符合,所以答案是:B;②第3周期的最高化合价从左→右依次升高,图象C符合,所以答案是:C;③因碱金属属于金属晶体,半径越大,金属键越弱,熔沸点越低,则碱金属单质的熔点随原子序数的增大而降低,图象A符合,所以答案是:A.(2)、①B、②C、③A (3)阴离子的中子数为N:AXn﹣共有x个电子,所以质子数为:x﹣n,根据中子数(N)=质量数(Z)﹣质子数(A)=A﹣x+n,所以答案是:A﹣x+n;(4)NH3是非电解质;Na2O是电解质;CO2是非电解质;CaCl2是电解质;CCl4是非电解质;N2是单质;NaHCO3是电解质;NaOH是电解质;Na2O2是电解质;NH4Cl是电解质;所以属于电解质的有6个,所以答案是:6个.
U(2)①ⅡA族元素的最外层电子数相等,图象B符合,所以答案是:B;②第3周期的最高化合价从左→右依次升高,图象C符合,所以答案是:C;③因碱金属属于金属晶体,半径越大,金属键越弱,熔沸点越低,则碱金属单质的熔点随原子序数的增大而降低,图象A符合,所以答案是:A.(2)、①B、②C、③A (3)阴离子的中子数为N:AXn﹣共有x个电子,所以质子数为:x﹣n,根据中子数(N)=质量数(Z)﹣质子数(A)=A﹣x+n,所以答案是:A﹣x+n;(4)NH3是非电解质;Na2O是电解质;CO2是非电解质;CaCl2是电解质;CCl4是非电解质;N2是单质;NaHCO3是电解质;NaOH是电解质;Na2O2是电解质;NH4Cl是电解质;所以属于电解质的有6个,所以答案是:6个.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案