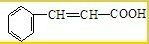
题目内容
(2009?肇庆一模)回收的废旧锌锰干电池经过处理后得到锰粉(含MnO2、Mn(OH)2、Fe、NH4Cl和炭黑等),由锰粉制取MnO2的步骤如图所示:
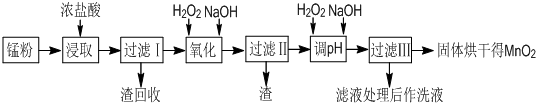
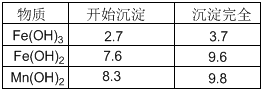
根据上图所示步骤并参考左边表格数据回答问题:
(1)在加热条件下用浓盐酸浸取锰粉,所得溶液中含有Mn2+、Fe2+等.MnO2与浓盐酸反应的离子方程式为
(2)锰粉经浓盐酸浸取,过滤I除去不溶杂质后,向滤液中加入足量H2O2溶液,其作用是
(3)过滤I的滤渣的化学式为
(4)将过滤I所得滤液经H2O2氧化后,再加入NaOH溶液调节pH的范围是
(5)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离于方程式为


根据上图所示步骤并参考左边表格数据回答问题:
(1)在加热条件下用浓盐酸浸取锰粉,所得溶液中含有Mn2+、Fe2+等.MnO2与浓盐酸反应的离子方程式为
MnO2+4H++2C1-=Mn2++C12↑+2H2O
MnO2+4H++2C1-=Mn2++C12↑+2H2O
;这种处理方法不足之处为:产生有毒的氯气
产生有毒的氯气
.(2)锰粉经浓盐酸浸取,过滤I除去不溶杂质后,向滤液中加入足量H2O2溶液,其作用是
将Fe2+转化为Fe3+
将Fe2+转化为Fe3+
.(3)过滤I的滤渣的化学式为
C
C
.过滤Ⅱ的滤渣的化学式为Fe(OH)3
Fe(OH)3
.(4)将过滤I所得滤液经H2O2氧化后,再加入NaOH溶液调节pH的范围是
3.7<pH<8.3
3.7<pH<8.3
:,其目的是使Fe3+完全沉淀,并防止Mn2+转化为Mn(OH)2沉淀
使Fe3+完全沉淀,并防止Mn2+转化为Mn(OH)2沉淀
.(5)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离于方程式为
Mn2++H2O2+2OH-=MnO2↓+2H2O
Mn2++H2O2+2OH-=MnO2↓+2H2O
.分析:(1)MnO2具有强氧化性,与浓盐酸反应生成氯气,氯气有毒,不能直接排放到空气中;
(2)过氧化氢具有强氧化性,可将具有还原性的Fe2+氧化为Fe3+;
(3)加入浓盐酸,只有炭黑不反应,可过滤分离,向滤液中加入足量H2O2溶液并加入NaOH溶液调节溶液PH后,可生成Fe(OH)3沉淀;
(4)由表中数据可知,调节溶液PH在3.7<pH<8.3之间,可使使Fe3+完全沉淀,并防止Mn2+转化为Mn(OH)2沉淀;
(5)过滤Ⅱ所得滤液中含有Mn2+,加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,根据反应物和生成物书写离子方程式.
(2)过氧化氢具有强氧化性,可将具有还原性的Fe2+氧化为Fe3+;
(3)加入浓盐酸,只有炭黑不反应,可过滤分离,向滤液中加入足量H2O2溶液并加入NaOH溶液调节溶液PH后,可生成Fe(OH)3沉淀;
(4)由表中数据可知,调节溶液PH在3.7<pH<8.3之间,可使使Fe3+完全沉淀,并防止Mn2+转化为Mn(OH)2沉淀;
(5)过滤Ⅱ所得滤液中含有Mn2+,加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,根据反应物和生成物书写离子方程式.
解答:解:(1)MnO2具有强氧化性,与浓盐酸反应生成氯气,反应的离子方程式为MnO2+4H++2C1-=Mn2++C12↑+2H2O,氯气有毒,不能直接排放到空气中,
故答案为:MnO2+4H++2C1-=Mn2++C12↑+2H2O;产生有毒的氯气;
(2)过氧化氢具有强氧化性,可将具有还原性的Fe2+氧化为Fe3+,易于转化为Fe(OH)3而除去,故答案为:将Fe2+转化为Fe3+;
(3)加入浓盐酸,只有炭黑不反应,可过滤分离,向滤液中加入足量H2O2溶液并加入NaOH溶液调节溶液PH后,可生成Fe(OH)3沉淀,故答案为:C;Fe(OH)3;
(4)由表中数据可知,调节溶液PH在3.7<pH<8.3之间,可使使Fe3+完全沉淀,并防止Mn2+转化为Mn(OH)2沉淀,
故答案为:3.7<pH<8.3;使Fe3+完全沉淀,并防止Mn2+转化为Mn(OH)2沉淀;
(5)过滤Ⅱ所得滤液中含有Mn2+,加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离子方程式为Mn2++H2O2+2OH-=MnO2↓+2H2O,
故答案为:Mn2++H2O2+2OH-=MnO2↓+2H2O.
故答案为:MnO2+4H++2C1-=Mn2++C12↑+2H2O;产生有毒的氯气;
(2)过氧化氢具有强氧化性,可将具有还原性的Fe2+氧化为Fe3+,易于转化为Fe(OH)3而除去,故答案为:将Fe2+转化为Fe3+;
(3)加入浓盐酸,只有炭黑不反应,可过滤分离,向滤液中加入足量H2O2溶液并加入NaOH溶液调节溶液PH后,可生成Fe(OH)3沉淀,故答案为:C;Fe(OH)3;
(4)由表中数据可知,调节溶液PH在3.7<pH<8.3之间,可使使Fe3+完全沉淀,并防止Mn2+转化为Mn(OH)2沉淀,
故答案为:3.7<pH<8.3;使Fe3+完全沉淀,并防止Mn2+转化为Mn(OH)2沉淀;
(5)过滤Ⅱ所得滤液中含有Mn2+,加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离子方程式为Mn2++H2O2+2OH-=MnO2↓+2H2O,
故答案为:Mn2++H2O2+2OH-=MnO2↓+2H2O.
点评:本题考查物质的制备和分离,题目难度中等,注意根据物质的性质把握实验原理,本题易错点为(5),注意根据反应物和生成物结合质量守恒书写离子方程式.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
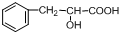 (2009?肇庆一模)有机物A是一种重要化工生产的中间体,其结构简式如下:
(2009?肇庆一模)有机物A是一种重要化工生产的中间体,其结构简式如下: