题目内容
(4分)25℃,1.01×10 Pa时8 g甲烷完全燃烧,当恢复至原状态时,放出445 kJ热量,此反应的热化学方程式为:________ ___________.
Pa时8 g甲烷完全燃烧,当恢复至原状态时,放出445 kJ热量,此反应的热化学方程式为:________ ___________.
 Pa时8 g甲烷完全燃烧,当恢复至原状态时,放出445 kJ热量,此反应的热化学方程式为:________ ___________.
Pa时8 g甲烷完全燃烧,当恢复至原状态时,放出445 kJ热量,此反应的热化学方程式为:________ ___________.(4分)CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ·mol-1
热化学方程式中的化学计量数表示物质的物质的量,8 g甲烷的物质的量为 ,从而可得
,从而可得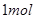 甲烷完全燃烧放出的热为890kJ,所以,此反应的热化学方程式为:
甲烷完全燃烧放出的热为890kJ,所以,此反应的热化学方程式为:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ·mol-1
 ,从而可得
,从而可得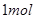 甲烷完全燃烧放出的热为890kJ,所以,此反应的热化学方程式为:
甲烷完全燃烧放出的热为890kJ,所以,此反应的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ·mol-1

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目