题目内容
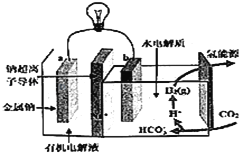
【题目】如图为相互串联的甲、乙两电解池,其中甲池为电解精炼铜的装置。

试回答下列问题:
(1)A是________极,材料是________,电极反应为_____________,B是________极,材料是________,主要电极反应为_________________,电解质溶液为________。
(2)乙池中若滴入少量酚酞溶液,电解一段时间后Fe极附近溶液呈________色。
(3)常温下,若甲池中阴极增重12.8 g,则乙池中阳极放出的气体在标准状况下的体积为________。若此时乙池剩余液体为400 mL,则电解后得到碱液的物质的量浓度为________,pH为________。
【答案】阴 纯铜 Cu2++2e-===Cu 阳 粗铜 Cu-2e-===Cu2+ CuSO4溶液(其他合理答案也可) 红 4.48 L 1.0 mol/L 14
【解析】
(1)依据电解精炼铜的原理是粗铜做阳极,精铜做阴极,含铜离子的电解质溶液进行电解反应,据此分析解答;
(2)依据装置图,与电源正极相连的石墨电极为电解池的阳极,与电源负极连的Fe为阴极,据此分析解答;
(3)依据电极反应和电子守恒计算甲池和乙池中电极产物的物质的量,乙池中依据氢离子和氢氧根离子守恒,水的离子积常数计算得到c(OH-)和pH。
(1)电解精炼铜的原理为:粗铜做阳极,精铜做阴极,含铜离子的电解质溶液(如CuSO4溶液)进行电解反应,在阴极是溶液中铜离子得到电子生成铜,电极反应是Cu2++2e-═Cu,在阳极上Cu失去电子生成铜离子,电极反应是Cu-2e-═Cu2+,故答案为:阴;精铜(或纯铜); Cu2++2e-=Cu;阳;粗铜;Cu-2e-═Cu2+;CuSO4溶液;
(2)依据装置图分析可知,与电源正极相连的石墨电极为电解池的阳极,与电源负极连接的铁电极是阴极,Fe电极上是溶液中氢离子得到电子生成氢气,电极反应为2H++2e-═H2↑,破坏水的电离平衡,氢氧根离子浓度增大,铁电极附近滴入少量酚酞溶液,溶液变红色,故答案为:红;
③甲池中A为电解池的阴极,电极反应为Cu2++2e-═Cu,12.8g铜的物质的量为0.2mol,增重12.8 g铜转移0.4mol电子;乙池C(石墨)极为电解池的阳极,电极反应为:2Cl--2e-═Cl2↑,依据得失电子守恒,生成氯气0.2mol,放出的氯气在标况下的体积为0.2mol×22.4L/mol=4.48L,Fe电极电解反应为:2H++2e-═H2↑,消耗氢离子物质的量0.4mol,依据水的电离氢离子和氢氧根离子守恒得到,生成氢氧根离子的c(OH-)=![]() =1mol/L,溶液pH=14,故答案为:4.48L;1mol/L;14。
=1mol/L,溶液pH=14,故答案为:4.48L;1mol/L;14。

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案