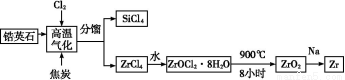
题目内容
Cu与一定浓度的HNO3反应为:3Cu+2NO3—+xH+ 3Cu2++2R+yH2O。
3Cu2++2R+yH2O。
(1)反应中的x= 。
(2)反应产物R的化学式为 。
(3)参加反应的Cu和消耗HNO3的物质的量之比为 。
(4)1.5 mol Cu完全反应时转移的电子数为 。
(1)8 (2)NO (3)3∶8 (4)3NA
【解析】根据化合价升降和电子守恒知R为NO,再根据电荷守恒可知x=8,把此离子方程式改写为化学方程式:3Cu+8HNO3 3Cu(NO3)2+2NO↑+4H2O,则参加反应的Cu和消耗HNO3的物质的量之比为3∶8,1.5 mol Cu失去电子的数目为1.5×2NA=3NA。
3Cu(NO3)2+2NO↑+4H2O,则参加反应的Cu和消耗HNO3的物质的量之比为3∶8,1.5 mol Cu失去电子的数目为1.5×2NA=3NA。

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
根据表中信息,判断下列叙述中正确的是( )
序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
① |
| FeBr2 | / |
| Cl- |
② | KClO3 | 浓盐酸 | / | Cl2 |
|
③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
A.表中①组的反应可能有一种或两种元素被氧化
B.氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2
C.表中②组反应的还原产物是KCl,电子转移数目是6NA
D.表中③组反应的离子方程式为:2MnO4—+3H2O2+6H+ 2Mn2++4O2↑+6H2O
2Mn2++4O2↑+6H2O