题目内容
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上合成甲醇的反应原理为:CO(g)+2H2(g)?CH3OH(g)△H,
下表所列数据是该反应在不同温度下的化学平衡常数(K).
①根据表中数据可判断△H
②在300℃时,将2mol CO、3mol H2和2mol CH3OH充入容积为1L的密闭容器中,此时反应将
A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1451.6kJ?mol-1
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ?mol-1
写出该条件下甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
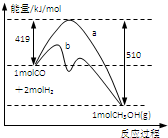
(3)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,则负极的电极反应式为
(4)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为
(1)工业上合成甲醇的反应原理为:CO(g)+2H2(g)?CH3OH(g)△H,
下表所列数据是该反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
<
<
0 (填“>”、“=”或“<”).②在300℃时,将2mol CO、3mol H2和2mol CH3OH充入容积为1L的密闭容器中,此时反应将
A
A
.A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1451.6kJ?mol-1
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ?mol-1
写出该条件下甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ?mol-1
CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ?mol-1
.(3)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,则负极的电极反应式为
CH3OH+8OH--6e-=CO32-+6H2O
CH3OH+8OH--6e-=CO32-+6H2O
,随着反应的不断进行溶液的pH减小
减小
(填“增大”“减小”或“不变”).(4)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为
2Cl--2e-=Cl2↑
2Cl--2e-=Cl2↑
一段时间后NaCl溶液的体积为1L,溶液的pH为12(25℃下测定),则理论上消耗氧气的体积为56
56
mL(标况下).分析:(1)①由表中数据可知,温度越高,平衡常数越小,说明升高温度平衡向逆反应移动;
②计算此时的浓度商Qc,与平衡常数比较,判断反应进行的方向;
(2)根据盖斯定律①-②可得甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式;
(3)负极发生氧化反应,甲醇在负极放电,氧气在正极放电,正极电极反应式为O2+2H2O+4e-=4OH-,总反应式减去正极反应式可得负极反应式,由电池总反应式可知OH-参加反应,OH-浓度降低;
(4)电解饱和食盐水,氯离子在阳极发生氧化反应生成氯气.电解一段时间,溶液的pH=12,则溶液中c(OH-)=0.01mol/L,则n(OH-)=0.01mol/L×1L=0.01mol,据此计算生成的氯气的物质的量,根据电子转移守恒计算原电池消耗的氧气的物质的量,进而计算体积.
②计算此时的浓度商Qc,与平衡常数比较,判断反应进行的方向;
(2)根据盖斯定律①-②可得甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式;
(3)负极发生氧化反应,甲醇在负极放电,氧气在正极放电,正极电极反应式为O2+2H2O+4e-=4OH-,总反应式减去正极反应式可得负极反应式,由电池总反应式可知OH-参加反应,OH-浓度降低;
(4)电解饱和食盐水,氯离子在阳极发生氧化反应生成氯气.电解一段时间,溶液的pH=12,则溶液中c(OH-)=0.01mol/L,则n(OH-)=0.01mol/L×1L=0.01mol,据此计算生成的氯气的物质的量,根据电子转移守恒计算原电池消耗的氧气的物质的量,进而计算体积.
解答:解:(1)①由表中数据可知,温度越高,平衡常数越小,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0,故答案为:<;
②、将2mol CO、3mol H2和2mol CH3OH充入容积为1L的密闭容器中,此时的浓度商Qc=
=
,小于0.27,故反应向正反应进行,故答案为:A;
(2)根据盖斯定律①-②可得 2CH3OH(l)+2O2(g)=2CO(g)+4H2O(l)△H=(-1451.6kJ?mol-1)-(-566.0kJ?mol-1)
=-885.6kJ?mol-1,
即CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8 kJ?mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8 kJ?mol-1;
(3)负极发生氧化反应,甲醇在负极放电,氧气在正极放电,正极电极反应式为3O2+6H2O+12e-=12OH-,电池总反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,总反应式减去正极反应式可得2CH3OH+16OH--12e-=2CO32-+12H2O,故负极反应式为:CH3OH+8OH--6e-=CO32-+6H2O,由电池总反应式可知OH-参加反应,OH-浓度降低,酸性增强,溶液pH减小,
故答案为:CH3OH+8OH--6e-=CO32-+6H2O;减小;
(4)电解饱和食盐水,氯离子在阳极发生氧化反应生成氯气,电极反应式为:2Cl--2e-=Cl2↑,电解一段时间,溶液的pH=12,则溶液中c(OH-)=0.01mol/L,则n(OH-)=0.01mol/L×1L=0.01mol,根据反应2NaCl+2H2O=H2↑+Cl2↑+2NaOH可知,n(Cl2)=0.01mol×
=0.005mol,根据电子转移守恒有4n(O2)=2n(Cl2),所以n(O2)=
=0.0025mol,故原电池消耗氧气的体积为0.0025mol×22.4L/mol=0.056L=56mL,故答案为:2Cl--2e-=Cl2↑;56.
②、将2mol CO、3mol H2和2mol CH3OH充入容积为1L的密闭容器中,此时的浓度商Qc=
| 2 |
| 2×32 |
| 1 |
| 9 |
(2)根据盖斯定律①-②可得 2CH3OH(l)+2O2(g)=2CO(g)+4H2O(l)△H=(-1451.6kJ?mol-1)-(-566.0kJ?mol-1)
=-885.6kJ?mol-1,
即CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8 kJ?mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8 kJ?mol-1;
(3)负极发生氧化反应,甲醇在负极放电,氧气在正极放电,正极电极反应式为3O2+6H2O+12e-=12OH-,电池总反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,总反应式减去正极反应式可得2CH3OH+16OH--12e-=2CO32-+12H2O,故负极反应式为:CH3OH+8OH--6e-=CO32-+6H2O,由电池总反应式可知OH-参加反应,OH-浓度降低,酸性增强,溶液pH减小,
故答案为:CH3OH+8OH--6e-=CO32-+6H2O;减小;
(4)电解饱和食盐水,氯离子在阳极发生氧化反应生成氯气,电极反应式为:2Cl--2e-=Cl2↑,电解一段时间,溶液的pH=12,则溶液中c(OH-)=0.01mol/L,则n(OH-)=0.01mol/L×1L=0.01mol,根据反应2NaCl+2H2O=H2↑+Cl2↑+2NaOH可知,n(Cl2)=0.01mol×
| 1 |
| 2 |
| 0.005mol×2 |
| 4 |
点评:本题目综合性较大,涉及化学平衡常数、热化学方程式、原电池与电解池工作原理及计算等,难度中等,注意(3)中利用总反应式减去正极反应式书写负极电极反应式时,转移电子数目应相等.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案
相关题目
 能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.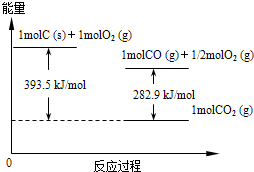 (2012?红桥区一模)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(2012?红桥区一模)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.