��Ŀ����
ijһ��Ӧ��ϵ�й���Pb3O4��NO��MnO2��Cr2O3��Cr(MnO4)2��Pb(N3)2�����Ƶ�����Ǧ������PbΪ+2�ۣ��������ʣ���֪Pb(N3)2�Ƿ�Ӧ��֮һ��Cr2O3�Dz���֮һ����ش��������⣺
(1����֪Cr�ij������ϼ�Ϊ+2��+3��+6��Mn�ij������ϼ�Ϊ+2��+4��+6��+7����Cr(MnO4)2��Cr�Ļ��ϼ�Ϊ ��
(2��1mol Pb(N3)2�ڷ�Ӧ�� (��õ�����ʧȥ���� mol���ӡ�
(3��д���÷�Ӧ�Ļ�ѧ����ʽ ��
(1����֪Cr�ij������ϼ�Ϊ+2��+3��+6��Mn�ij������ϼ�Ϊ+2��+4��+6��+7����Cr(MnO4)2��Cr�Ļ��ϼ�Ϊ ��
(2��1mol Pb(N3)2�ڷ�Ӧ�� (��õ�����ʧȥ���� mol���ӡ�
(3��д���÷�Ӧ�Ļ�ѧ����ʽ ��
��8�֣�ÿ��2�֣�
��1��+2 ��2��ʧȥ 44/3��14.6
��3��15 Pb(N3)2+ 44Cr(MnO4)2=5Pb3O4+90NO��+88MnO2+22Cr2O3
��1��+2 ��2��ʧȥ 44/3��14.6
��3��15 Pb(N3)2+ 44Cr(MnO4)2=5Pb3O4+90NO��+88MnO2+22Cr2O3
���������Pb(N3)2�Ƿ�Ӧ��֮һ��Pb3O4��NO�϶��Dz��Pb(N3)2�Dz�ԭ������һ��Ӧ����Ԫ�ػ��ϼ�Ҫ���ͣ�Cr(MnO4)2����������MnO2�ǻ�ԭ���
��1��Cr(MnO4)2��Cr�Ļ��ϼ��ɻ�ѧʽ��֪���϶���ż�����ɻ��ϼ۴����͵���0��MnΪ+7��ʱ��CrΪ+2�ۣ�������MnΪ+6��ʱ��CrΪ+4�ۣ����������𰸣�+2����Pb(N3)2��Pb��+2������
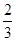 �ۣ����
�ۣ����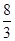 ��N��-
��N��-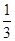 ����
����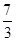 ���+2�ۣ�1mol Pb(N3)2�ڷ�Ӧ�й�ʧȥ
���+2�ۣ�1mol Pb(N3)2�ڷ�Ӧ�й�ʧȥ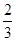 +6��
+6��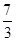 =
=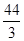 ���𰸣�ʧȥ 44/3��14.6����1mol Pb(N3)2�ڷ�Ӧ�й�ʧȥ
���𰸣�ʧȥ 44/3��14.6����1mol Pb(N3)2�ڷ�Ӧ�й�ʧȥ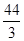 mol���ӣ�1molCr(MnO4)2�õ�6mol���ӣ�ʧȥ1mol���ӣ�����5mol���ӣ��ɵ�ʧ�����غ����ƽ����ʽ��Pb(N3)2ǰ��15��Cr(MnO4)2ǰ��44���ٸ��������غ㣬���ѽ�����ʽ��ƽ��15 Pb(N3)2+ 44Cr(MnO4)2=5Pb3O4+90NO��+88MnO2+22Cr2O3���𰸣�15 Pb(N3)2+ 44Cr(MnO4)2=5Pb3O4+90NO��+88MnO2+22Cr2O3��
mol���ӣ�1molCr(MnO4)2�õ�6mol���ӣ�ʧȥ1mol���ӣ�����5mol���ӣ��ɵ�ʧ�����غ����ƽ����ʽ��Pb(N3)2ǰ��15��Cr(MnO4)2ǰ��44���ٸ��������غ㣬���ѽ�����ʽ��ƽ��15 Pb(N3)2+ 44Cr(MnO4)2=5Pb3O4+90NO��+88MnO2+22Cr2O3���𰸣�15 Pb(N3)2+ 44Cr(MnO4)2=5Pb3O4+90NO��+88MnO2+22Cr2O3��
��ϰ��ϵ�д�
 �㽭��У��ʦ���ϵ�д�
�㽭��У��ʦ���ϵ�д� ȫ�ų��100��ϵ�д�
ȫ�ų��100��ϵ�д�
�����Ŀ
 ______ �� ______ �� N2O�� �� H2O
______ �� ______ �� N2O�� �� H2O Cu(NO3)2
Cu(NO3)2 CuO
CuO Cu(OH)2
Cu(OH)2 CuSO4
CuSO4 Cu(NO3)2
Cu(NO3)2
 BrO��
BrO��