题目内容
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3→K2O+5Na2O+16N2↑。则下列判断不正确的是
| A.若氧化产物比还原产物多0.35mol,有0.050molKNO3被氧化 |
| B.若氧化产物比还原产物多0.35mol,生成8.96LN2(标准状况) |
| C.若有0.2mol氧化剂反应,则转移电子的物质的量为1.0mol |
| D.KNO3的氧化性强于N2 |
A
试题分析:A:在该反应中KNO3被还原,错误。B在反应10NaN3+2KNO3→K2O+5Na2O+16N2↑中,每有10摩尔NaN3反应就生成15摩尔氧化产物N2,2摩尔KNO3生成1摩尔还原产物N2即氧化产物比还原产物多14mol,生成,16×22.4LN2,若氧化产物比还原产物多0.35mol,生成标准状况N28.96L,正确。D在氧化还原反应中,氧化性:氧化剂大于氧化产物,KNO3氧化剂N2是氧化产物,正确。

练习册系列答案
相关题目
 与足量的2mol/L硫酸液混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体 ③溶液呈现蓝色。据此判断下列说法正确的是( )
与足量的2mol/L硫酸液混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体 ③溶液呈现蓝色。据此判断下列说法正确的是( )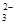 +O2+xOH—
+O2+xOH— +2H2O,
+2H2O,