题目内容
(14分)下表是元素周期表的一部分,回答下列有关问题:
小题1:写出下列元素符号:④ ;? 。
小题2:画出原子的结构示意图:⑤ ;? 。
小题3:在①~?元素中,金属性最强的元素是_________,非金属性最强的元素是_______,最不活泼的元素是________。(均填元素符号)
小题4:元素⑦与元素⑧相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 。
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
小题5: 第三周期中原子半径最大的元素跟它同周期中原子半径最小的元素(稀有气体除外)可以形成 (填离子或共价)化合物。
小题6:元素⑥是构成地壳的主要元素之一,其氧化物是现代光学及光纤制品的基本原料,该氧化物的化学式为____________该氧化物中含有的化学键是_________键(填“离子”或“共价”)
小题7: 在一定条件下,若将元素①的单质和氢气的混合气体通入4L的密闭容器中发生反应,半分钟后测得生成物的物质的量为1.4 mol,则用元素①的单质表示的反应速率为________________________。
| 周期\主族 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | | ① | | ② | |
| 3 | ③ | ④ | ⑤ | ⑥ | | ⑦ | ⑧ | ⑨ |
| 4 | ⑩ | ? | | | | | ? | |
小题1:写出下列元素符号:④ ;? 。
小题2:画出原子的结构示意图:⑤ ;? 。
小题3:在①~?元素中,金属性最强的元素是_________,非金属性最强的元素是_______,最不活泼的元素是________。(均填元素符号)
小题4:元素⑦与元素⑧相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 。
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
小题5: 第三周期中原子半径最大的元素跟它同周期中原子半径最小的元素(稀有气体除外)可以形成 (填离子或共价)化合物。
小题6:元素⑥是构成地壳的主要元素之一,其氧化物是现代光学及光纤制品的基本原料,该氧化物的化学式为____________该氧化物中含有的化学键是_________键(填“离子”或“共价”)
小题7: 在一定条件下,若将元素①的单质和氢气的混合气体通入4L的密闭容器中发生反应,半分钟后测得生成物的物质的量为1.4 mol,则用元素①的单质表示的反应速率为________________________。
小题1:④ Mg ;? Br 。(每空1分)
小题1:⑤
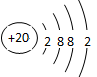
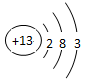 ;?
;? 
小题1:K, F, Ar。
小题1: Cl b 。
小题1:离子
小题1:SiO2,
小题1:0.0058mol.L-1.S-1或0.35 mol.L-1.min-1。
考查元素周期表的结构和元素周期律的应用。根据元素在周期表中的位置可知①~?分别为N、F、Na、Mg、Al、Si、S、Cl、Ar、K、Ca、Br。
(1)、(2)略
(3)同周期元素自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。同主族元素自上而下原子半径逐渐增大,非金属性逐渐减弱,金属性逐渐增强。所以金属性最强的是K,非金属性最强的是F。稀有气体的最外层已经满足稳定结构,化学性质最不活泼。
(4)比较元素的非金属性可以利用最高价氧化物的水化物的酸性强弱,或者和氢气化合的难易程度以及氢化物的稳定性,也可以利用它们之间的相互置换能力。所以答案是b。
(5)第三周期中原子半径最大的元素跟它同周期中原子半径最小的元素分别是Na和Cl,均属于活泼的金属和活泼的非金属,形成的化学键是离子键,形成的化合物是离子化合物NaCl。
(6)光纤制品的基本原料是SiO2,硅和氧均是非金属元素,二者形成的化学键是极性键。
(7)反应速率通常用单位时间内浓度的变化量来表示,合成氨的方程式为N2+3H2 2NH3,半分钟后测得生成物的物质的量为1.4 mol,则消耗氮气的物质的量是0.7mol,所以用氮气表示的反应速率为
2NH3,半分钟后测得生成物的物质的量为1.4 mol,则消耗氮气的物质的量是0.7mol,所以用氮气表示的反应速率为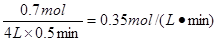 。
。
(1)、(2)略
(3)同周期元素自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。同主族元素自上而下原子半径逐渐增大,非金属性逐渐减弱,金属性逐渐增强。所以金属性最强的是K,非金属性最强的是F。稀有气体的最外层已经满足稳定结构,化学性质最不活泼。
(4)比较元素的非金属性可以利用最高价氧化物的水化物的酸性强弱,或者和氢气化合的难易程度以及氢化物的稳定性,也可以利用它们之间的相互置换能力。所以答案是b。
(5)第三周期中原子半径最大的元素跟它同周期中原子半径最小的元素分别是Na和Cl,均属于活泼的金属和活泼的非金属,形成的化学键是离子键,形成的化合物是离子化合物NaCl。
(6)光纤制品的基本原料是SiO2,硅和氧均是非金属元素,二者形成的化学键是极性键。
(7)反应速率通常用单位时间内浓度的变化量来表示,合成氨的方程式为N2+3H2
 2NH3,半分钟后测得生成物的物质的量为1.4 mol,则消耗氮气的物质的量是0.7mol,所以用氮气表示的反应速率为
2NH3,半分钟后测得生成物的物质的量为1.4 mol,则消耗氮气的物质的量是0.7mol,所以用氮气表示的反应速率为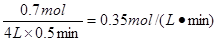 。
。
练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目


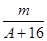 (A-n+8)mol
(A-n+8)mol 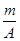 (A-n+6)mol
(A-n+6)mol