题目内容
【题目】金属镍具有较高的经济价值。工业上采用一定方法处理含镍废水使其达标排放并回收镍。某电镀废水中的镍主要以NiRz络合物形式存在,在水溶液中存在以下平衡: NiR2(aq) ![]() Ni2+(aq) +2R-(aq) (R-为有机物配体,K=1.6×10-14)
Ni2+(aq) +2R-(aq) (R-为有机物配体,K=1.6×10-14)
(1)传统的“硫化物沉淀法”是向废水中加入Na2S,使其中的NiR2 生成NiS 沉淀进而回收镍。
①该反应的离子方程式为_______________。
②NiS 沉淀生成的同时会有少量Ni(OH)2沉淀生成,用离子方程式解释Ni(OH)2生成的原因是______________。
(2)“硫化物沉淀法”镍的回收率不高,处理后废水中的镍含量难以达标。“铁脱络-化学沉淀法”可达到预期效果,该法将镍转化为Ni(OH)2固体进而回收镍。工艺流程如下:
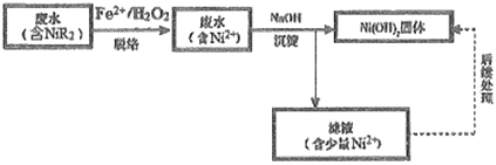
“脱络”(指镍元素由络合物NiR2转化成游离的Ni3+) 过程中,R-与中间产物-OH (羟基自由基) 反应生成难以与Ni2+络合的-R (有机物自由基),但-OH也能与H2O2发生反应。反应的方程式如下:Fe2+ + H2O2 = Fe3+ +OH-+-OH i
R- +-OH =OH-+-R ii
H2O2+2-OH=O2↑+ 2H2O iii
实验测得“脱络”过程中H2O2的加入量对溶液中镍去除率的影响如图所示:
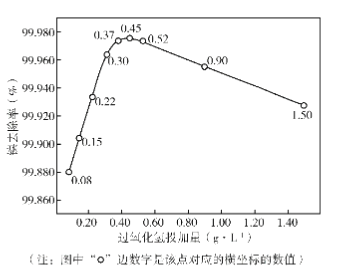
①从平衡移动的角度解释加入Fe2+和H2O2能够实现“脱络”的原因是______________。
②分析图中曲线,可推断过氧化氢的最佳加入量为_______________ g/ L; 低于或高于这个值,废水处理效果都下降,原因是____________。
(3) 工业上还可用电解法制取三氧化二镍。①用NaOH溶液调节NiCl2溶液PH至7.5,加入适量硫酸钠后采用情性电极进行电解。电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍。写出ClO- 氧化Ni (OH) 2生成三氧化二镍的离子方程式是______, amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量是_________。
②电解法制取三氧化二镍实际过程中,有时获得一种结晶水合物,已知1mol 该物质中含有0.5mol结晶水。取该化合物20.2g进行充分加热,而获得三氧化二镍固体和0.2mol水,则该结晶水合物的化学式为______。
【答案】 NiR2+S2-=NiS↓+2R- S2-+H2O![]() HS-+OH- NiR2+2OH-=Ni(OH)2↓+2R- NiR2在溶液中存在平衡:NiR2(aq)
HS-+OH- NiR2+2OH-=Ni(OH)2↓+2R- NiR2在溶液中存在平衡:NiR2(aq)![]() Ni2+(aq)+2R-(aq),Fe2+和H2O2通过反应i和反应ⅱ将R-转化成难以与Ni2+络合的·R,使c(R-)减小,平衡正向移动,实现“脱絡” 0.45 低于此数值,反应i生成的-OH过少,不足以使R-充分转化成-R;高于此数值,H2O2多,但反应i生成-OH能与H2O2发生反应ⅲ,使H2O2转化成O2和H2O,同样不能使R-充分转化成-R C1O-+2Ni(OH)2=Cl-+Ni2O3+2H2O 1.25amol NiOOH·
Ni2+(aq)+2R-(aq),Fe2+和H2O2通过反应i和反应ⅱ将R-转化成难以与Ni2+络合的·R,使c(R-)减小,平衡正向移动,实现“脱絡” 0.45 低于此数值,反应i生成的-OH过少,不足以使R-充分转化成-R;高于此数值,H2O2多,但反应i生成-OH能与H2O2发生反应ⅲ,使H2O2转化成O2和H2O,同样不能使R-充分转化成-R C1O-+2Ni(OH)2=Cl-+Ni2O3+2H2O 1.25amol NiOOH·![]() H2O或2NiOOH·H2O
H2O或2NiOOH·H2O
【解析】考查化学工艺流程,(1)①根据废水中存在:NiR2(aq) ![]() Ni2+(aq)+2R-(aq),加入Na2S,Ni2+与S2-反应生成NiS,因此离子方程式为NiR2+S2-=NiS↓+2R-;②Na2S属于强碱弱酸盐,S2-发生水解,S2-+H2O
Ni2+(aq)+2R-(aq),加入Na2S,Ni2+与S2-反应生成NiS,因此离子方程式为NiR2+S2-=NiS↓+2R-;②Na2S属于强碱弱酸盐,S2-发生水解,S2-+H2O![]() HS-+OH-,Ni2+与OH-反应生成Ni(OH)2,综上所述有: S2-+H2O
HS-+OH-,Ni2+与OH-反应生成Ni(OH)2,综上所述有: S2-+H2O![]() HS-+OH- NiR2+2OH-=Ni(OH)2↓+2R- ;(2)脱络是指镍元素由络合物NiR2转化成游离的Ni3+,R-与中间产物-OH (羟基自由基) 反应生成难以与Ni2+络合的-R (有机物自由基),NiR2溶液中存在NiR2(aq)
HS-+OH- NiR2+2OH-=Ni(OH)2↓+2R- ;(2)脱络是指镍元素由络合物NiR2转化成游离的Ni3+,R-与中间产物-OH (羟基自由基) 反应生成难以与Ni2+络合的-R (有机物自由基),NiR2溶液中存在NiR2(aq) ![]() Ni2+(aq)+2R-(aq),加入Fe2+和H2O2,依据反应i和反应ii,将R-转化成难以与Ni2+络合的-R,使c(R-)减小,平衡正向移动,实现“脱络”;②根据镍去除率的图像,当过氧化氢的投加量为0.45g·L-1时,去除率达到最大,即过氧化氢的最佳加入量为0.45g·L-1;低于此值时,反应i种产生的-OH的量少,不足以使R-转化成-R,高于此值时,H2O2多,H2O2与-OH会发生反应iii,不能使R-充分转化成-R;(3)①ClO-把Ni(OH)2氧化成Ni2O3,本身被还原成Cl-,因此离子方程式为ClO-+Ni(OH)2→Ni2O3+Cl-,根据化合价的升降法进行配平,即离子方程式为ClO-+2Ni(OH)2=Cl- +Ni2O3+2H2O;根据离子方程式,消耗amolNi(OH)2的同时消耗a/2mol的ClO-,Cl2有80%在弱碱性转化成ClO-,即Cl2+2OH-=ClO-+Cl-+H2O,电解过程中产生氯气的量为0.5a/80%mol,电解过程种2Cl--2e-=Cl2,因此外电路转移电子物质的量为0.5a×2/80%mol=1.25a;②产生H2O的质量为0.2×18g=3.6g,根据质量守恒,Ni2O3的质量为(20.2-3.6)g=16.6g,即Ni2O3的物质的量为0.1mol,n(Ni2O3):n(H2O)=0.1:0.2=1:2,根据原子守恒和元素守恒,得出化学式为NiOOH·
Ni2+(aq)+2R-(aq),加入Fe2+和H2O2,依据反应i和反应ii,将R-转化成难以与Ni2+络合的-R,使c(R-)减小,平衡正向移动,实现“脱络”;②根据镍去除率的图像,当过氧化氢的投加量为0.45g·L-1时,去除率达到最大,即过氧化氢的最佳加入量为0.45g·L-1;低于此值时,反应i种产生的-OH的量少,不足以使R-转化成-R,高于此值时,H2O2多,H2O2与-OH会发生反应iii,不能使R-充分转化成-R;(3)①ClO-把Ni(OH)2氧化成Ni2O3,本身被还原成Cl-,因此离子方程式为ClO-+Ni(OH)2→Ni2O3+Cl-,根据化合价的升降法进行配平,即离子方程式为ClO-+2Ni(OH)2=Cl- +Ni2O3+2H2O;根据离子方程式,消耗amolNi(OH)2的同时消耗a/2mol的ClO-,Cl2有80%在弱碱性转化成ClO-,即Cl2+2OH-=ClO-+Cl-+H2O,电解过程中产生氯气的量为0.5a/80%mol,电解过程种2Cl--2e-=Cl2,因此外电路转移电子物质的量为0.5a×2/80%mol=1.25a;②产生H2O的质量为0.2×18g=3.6g,根据质量守恒,Ni2O3的质量为(20.2-3.6)g=16.6g,即Ni2O3的物质的量为0.1mol,n(Ni2O3):n(H2O)=0.1:0.2=1:2,根据原子守恒和元素守恒,得出化学式为NiOOH·![]() H2O或2NiOOH·H2O。
H2O或2NiOOH·H2O。