题目内容
(8分)(1)10mLpH=5的盐酸,稀释1000倍时,pH__________。
(2)常温下,pH=5和pH=3的盐酸溶液等体积混合后溶液的pH=_________。
(3) 某温度(t℃)时,水的KW=10-13,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,若所得混合溶液为中性,则a:b=_________;
若所得混合溶液pH=2,则a:b=__________。
(1)小于7 (2)3.3 (3)10:1 9:2

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(12分)图表法、图象法是常用的科学研究方法。
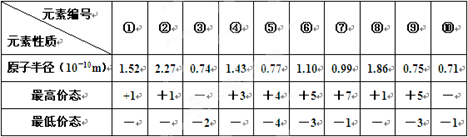
下表列出前20号元素中的某些元素性质的一些数据:
| 元素 性质 | A | B[ | C | D | E | F | G | H | I | J |
| 原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | — | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | — | -2 | — | -4 | -3 | -1 | — | -3 | -4 |
(1)已知H为Na元素,则以上10种元素中第一电离能最小的是: (填编号)。比元素B原子序数大10的元素其基态原子的核外电子排布是
 。
。(2)由上述C、E、G三种元素中的某两种元素形成的化合物中,每个原子的最外层都满足8电子稳定结构的可能是 (写分子式,写出一种即可),元素G、I分别和J形成的两种化合物的晶体类型分别是 。
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其一分子中共形
成
 个σ键, 个π键。
个σ键, 个π键。(4)短周期某主族元素K的电离能情况如图(A)所示。
则K元素位于周期表的第 族。

图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律。
不同同学对某主族元素的氢化物的沸点的变化趋势画出了两条折线—折线a和折线b,你认为正确的是 ,理由是
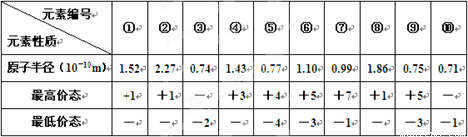
(分)下表列出了前20号元素中的某些元素性质的有关数据:
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | / | +3 | +4 | +5 | +7 | +1 | +5 | / |
| 最低价态 | / | / | -2 | / | -4 | -3 | -1 | / | -3 | -1 |
试回答下列问题:
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是(填写编号) 。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式) 。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于 ;若物质Na2R2是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式 。
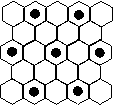
(3)元素⑤的某种单质具有平面层状结构,同一层中 的原子构成许许多多的正六边形,此单质与熔融的② 单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质的化学式为 。