题目内容
5.已知某温度下中性溶液中氢离子浓度为10-6.5mol/L,此温度下,PH=11的苛性钠溶液aL与PH=1的稀硫酸bL混合,试通过计算填写下列空格;(1)若所得混合液为中性,则a:b=10:1此溶液中各离子浓度大小排列顺序为c(Na+)>c(SO42-)>c(H+)=c(OH-);
(2)若所得混合液的PH=2,则a:b=9:2.溶液中各离子浓度大小顺序为c(H+)>c(SO42-)>c(Na+)>c(OH-)..
分析 某温度下中性溶液中氢离子浓度为10-6.5mol/L,则氢氧根的浓度也为10-6.5mol/L,故此温度下,水的离子积为10-13.
(1)溶液呈中性,说明酸和碱恰好完全反应,根据溶液的酸碱性及电荷守恒确定离子浓度大小;
(2)若所得混合液的pH=2,根据c(H+)=$\frac{C(酸)V(酸)-C(碱)V(碱)}{V(酸)+V(碱)}$计算酸碱的体积比,根据溶液的酸碱性及物料守恒判断离子浓度大小.
解答 解:某温度下中性溶液中氢离子浓度为10-6.5mol/L,则氢氧根的浓度也为10-6.5mol/L,故此温度下,水的离子积为10-13.
(1)若所得混合液为中性,则有:0.01a=0.1b,
解得:a:b=10:1;
混合溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得:c(Na+)>c(SO42- ),该溶液为盐溶液,硫酸根离子浓度大于氢离子浓度,所以离子浓度大小顺序是:c(Na+)>c(SO42-)>c(H+)=c(OH-),
故答案为:10:1; c(Na+)>c(SO42- )>c(H+)=c(OH-);
②若所得混合液的pH=2,则有:$\frac{0.1b-0.01a}{a+b}$=0.01,
解得:a:b=9:2;
溶液呈酸性,则:c(H+)>c(OH-),
溶液中氢离子浓度为0.01mol/L,硫酸根离子浓度为:$\frac{0.05×2}{2+9}$mol/L=0.009mol/L,
所以氢离子浓度大于硫酸根离子浓度,根据物料守恒知,c(SO42-)>(Na+),氢氧根离子浓度最小,
所以离子浓度大小顺序为:c(H+)>c(SO42- )>c(Na+)>c(OH-),
故答案为:9:2;c(H+)>c(SO42- )>c(Na+)>c(OH-).
点评 本题考查酸碱混合的定性判断,题目难度中等,注意掌握根据溶液的酸碱性及电荷守恒判断离子浓度大小的方法,注意(2)中水的离子积常数是10-13而不是10-14,为易错点.

| 物质及其杂质 | 检验 | 除杂 | |
| A | Cl2(HCl) | 湿润的淀粉KI试纸 | 饱和食盐水 |
| B | NaHCO3溶液(Na2CO3) | Ca(OH)2溶液 | 过量CO2 |
| C | CO2(HCl) | AgNO3溶液(含稀硝酸) | 饱和Na2CO3 |
| D | NO(NO2) | 观察颜色或湿润的淀粉KI试纸 | 水 |
| A. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02NA | |
| B. | 常温常压下,32g O2和O3的混合气体所含原子数为2NA | |
| C. | 标准状况下,22.4L氦气含有的分子数约为NA | |
| D. | 500mL0.2mol•L-1BaCl2溶液中Cl-浓度为0.2 mol•L-1 |
| A. | 质子数为37的氯原子:${\;}_{33}^{17}$Cl | |
| B. | Al(OH)3的电离方程式:H++AlO2═Al(0H)3═Al3++3OH- | |
| C. | CO2的结构式:O=C=O | |
| D. | 次氯酸分子的电子式: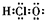 |
| A. | 氯气通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| B. | 过量的氯气通入溴化亚铁溶液中:3Cl2+2Fe2++4Br-=6Cl-+2Fe3++2Br2 | |
| C. | 次氯酸钠溶液中加入少量硫酸亚铁溶液:Fe2++2ClO-+H2O=Fe(OH)2↓+2HClO | |
| D. | NaHCO3溶液与过量Ba(OH)2溶液混合:2HCO3-+2OH-+Ba2+=BaCO3↓+CO32-+2H2O |
| A. | 澄清溶液中只含有SO42-一种阴离子 | |
| B. | 澄清溶液中只含有CO32-一种阴离子 | |
| C. | 澄清溶液中一定含有CO32- | |
| D. | 澄清溶液中一定含有H2SO4 |
| A. | CH3CH3+Cl2$\stackrel{光}{→}$CH3CH2Cl+HCl | B. | 2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH | ||
| C. |  +Br2$\stackrel{Fe}{→}$ +Br2$\stackrel{Fe}{→}$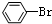 +HBr +HBr | D. |  +HNO3$→_{50-60℃}^{浓硫酸}$ +HNO3$→_{50-60℃}^{浓硫酸}$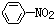 +H2O +H2O |