题目内容
11.下列叙述正确的是( )| A. | 1摩尔氢为2克 | B. | H2O的摩尔质量为18克 | ||
| C. | 44克CO2的体积为22.4L | D. | 9.8克H2SO4含0.1NA个H2SO4分子 |
分析 A.物质的量只适用微观粒子,1摩尔氢未指明是何种微粒;
B.摩尔质量单位使用错误,其单位是g/mol;
C.Vm=22.4L/mol指标准状况下,该题没有说明是标准状况,体积不一定是22.4L;
D.根据n=$\frac{m}{M}$,N=nNA计算.
解答 解:A.物质的量只适用微观粒子,不能说1摩尔氢,应该说1摩尔氢气分子或1摩尔氢原子,故A错误;
B.摩尔质量的单位是g/mol,则H2O的摩尔质量为18g/mol,故B错误;
C.没有说明是标准状况,则不能用Vm=22.4L/mol,无法求出44克CO2的体积,故C错误;
D.9.8克H2SO4的物质的量为n=$\frac{m}{M}$=$\frac{9.8g}{98g/mol}$=0.1mol,则9.8克H2SO4含0.1NA个H2SO4分子,故D正确;
故选D.
点评 本题考查了物质的量的含义及计算、体积摩尔体积的应用等,注意把握气体摩尔体积的适用条件,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.《化学反应原理》模块从不同的视角对化学反应进行了探究、分析.以下观点中不正确的是( )
①放热反应在常温下均能自发进行; ②电解过程中,化学能转化为电能而“储存”起来;
③原电池工作时所发生的反应一定有氧化还原反应; ④加热时,放热反应的v(正)会减小;
⑤盐类均能发生水解反应; ⑥化学平衡常数的表达式与化学反应方程式的书写无关.
①放热反应在常温下均能自发进行; ②电解过程中,化学能转化为电能而“储存”起来;
③原电池工作时所发生的反应一定有氧化还原反应; ④加热时,放热反应的v(正)会减小;
⑤盐类均能发生水解反应; ⑥化学平衡常数的表达式与化学反应方程式的书写无关.
| A. | ①②④⑤⑥ | B. | ①④⑤⑥ | C. | ②③⑤⑥ | D. | ①②④⑤ |
2.下列有关元素的性质及递变规律中错误的是( )
| A. | IA族与VIIA族元素间可形成共价化合物或离子化合物 | |
| B. | 第三周期元素从左到右,最高正价从+1 递增到+7 | |
| C. | 同主族元素的简单阴离子还原性越强,其在水中越容易水解 | |
| D. | 同周期的主族金属元素的化合价越高,其原子失电子能力越弱 |
19.下列叙述中,能肯定A金属比B金属活泼性强的是( )
| A. | A原子的最外层电子数比B原子的最外层电子数少 | |
| B. | A原子的电子层数比B原子的电子层数多 | |
| C. | 1 molA从酸中置换出的H2比1 molB从酸中置换出的氢气多 | |
| D. | 常温时,A能从水中置换出氢气而B不能 |
6.下表是A、B、C、D、E五种有机物的有关信息:
回答下列问题:
(1)A~E中,属于烃的是AB(填字母).A中含官能团名称是碳碳双键.
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br.
(3)C催化氧化生成D的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(4)有机物B具有的性质是②③(填序号).
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色.
| A | ①能使溴的四氯化碳溶液褪色; ②比例模型为  ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成;②球棍模型为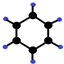 |
| C | ①由C、H、O三种元素组成;②能与Na反应; ③与E反应生成相对分子质量为88的酯 |
| D | ①相对分子质量比C少2;②能由C催化氧化得到 |
| E | ①由C、H、O三种元素组成;②其水溶液能使紫色石蕊试液变红 |
(1)A~E中,属于烃的是AB(填字母).A中含官能团名称是碳碳双键.
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br.
(3)C催化氧化生成D的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(4)有机物B具有的性质是②③(填序号).
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色.
 A~H都是初中化学中常见的物质,已知B为黑色固体,D为红色固体单质,F为红色固体,H溶液中的溶质是一种盐.它们的转化关系如图所示.请回答:
A~H都是初中化学中常见的物质,已知B为黑色固体,D为红色固体单质,F为红色固体,H溶液中的溶质是一种盐.它们的转化关系如图所示.请回答: