题目内容
3.下列说法正确的是( )| A. | 向Na2S2O3稀溶液中加入稀硫酸,发生如下反应:S2O32-+2H+=SO2↑+S↓+H2O,利用产生浑浊的快慢或产生气泡的快慢可以测定该反应在不同条件下的反应速率 | |
| B. | 在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度 | |
| C. | 容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| D. | 往装有铁钉的试管中加入2 mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,可以观察到铁钉表面粘附气泡,同时周围出现蓝色沉淀,这说明铁钉发生了吸氧腐蚀 |
分析 A.S2O32-+2H+═SO2↑+S↓+H2O反应中单位时间内生成的沉淀或气体无法定量测定;
B.起始温度应为混合前酸、碱的温度;
C.容量瓶、量筒和滴定管均在常温使用,只有滴定管有0刻度,且使用时必须润洗;
D.Fe与醋酸反应生成亚铁离子,亚铁离子与K3[Fe(CN)6]反应生成蓝色沉淀.
解答 解:A.S2O32-+2H+═SO2↑+S↓+H2O反应中单位时间内生成的沉淀或气体无法定量测定,所以向Na2S2O3稀溶液中加入稀硫酸,发生如下反应:S2O32-+2H+═SO2↑+S↓+H2O,不能利用产生浑浊的快慢或产生气泡的快慢来测定该反应在不同条件下的反应速率,故A错误;
B.起始温度应为混合前酸、碱的温度,然后混合后测定最高温度,以此计算中和热,故B错误;
C.容量瓶、量筒和滴定管上都标有刻度,使用时避免热胀冷缩,所以标有使用温度,量筒“0”刻度就是底座、容量瓶只有最大容量的一个刻度,所以两者都无“0”刻度,使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗因还需加水定容,故C正确;
D.Fe与醋酸反应生成亚铁离子,亚铁离子与K3[Fe(CN)6]反应生成蓝色沉淀,发生析氢腐蚀,故D错误.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及反应速率、中和热测定、仪器的使用以及金属腐蚀等,把握物质的性质、反应原理、实验技能为解答的关键,侧重分析与实验能力的考查,选项A为解答的难点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 2.4g金属镁变成镁离子时失去的电子数为0.2NA | |
| B. | 常温常压下,1mol氦气所含原子数为2NA | |
| C. | 标准状况下,22.4L CCl4含有的氯原子数为4NA | |
| D. | 0.5mol•L-1 Na2CO3溶液中含有Na+离子的数目为NA |
18.下列图示与对应的叙述相符的是( )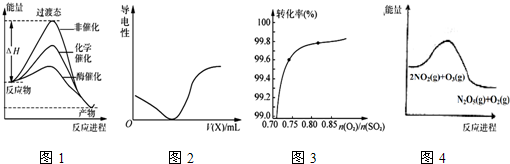

| A. | 由图1所示曲线可知,化学催化比酶催化的效果好 | |
| B. | 在H2S溶液导电性实验中,由图2所示曲线可确定通入的气体X为Cl2 | |
| C. | 其它条件不变,关于反应2SO2(g)+O2(g)$?_{加热}^{催化剂}$2SO3(g),图3中纵坐标表示O2的转化率 | |
| D. | 图4的反应升高温度,平衡常数减小 |
15.下列各组离子反应可用H++OH-=H2O表示的是( )
| A. | 硝酸和氢氧化钠 | B. | 氢氧化铁和盐酸 | C. | 氢氧化钡和硫酸 | D. | 碳酸氢钠和盐酸 |
13.常温下将盛有15mLNO2和20mLNO的混合气体的试管倒立于水槽中,并向其中通入O2一段时间后,试管内还剩余5mL气体,则通入O2的体积为( )
| A. | 8mL | B. | 10mL | C. | 15mL | D. | 23.75mL |
 下面是有关物质的转化关系图(部分产物已省略),其中A为单质,E在常温下为液体,D是一种气体,C的相对分子质量为78.请回答下列有关问题:
下面是有关物质的转化关系图(部分产物已省略),其中A为单质,E在常温下为液体,D是一种气体,C的相对分子质量为78.请回答下列有关问题: ;
;