题目内容
(16分)利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。
Ⅰ.染料工业排放的废水中含有大量有毒的NO2¯,可以在碱性条件下加入铝粉除去(加热处理后的废水,会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO2-的离子方程式为 。
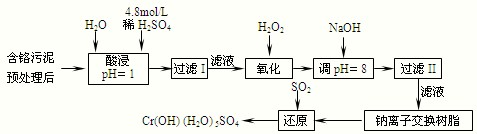
Ⅱ.某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | —— | —— | 4.7 | —— |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
(1)实验室用18.4 mol·L-1的浓硫酸配制250 mL 4.8 mol·L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需 。
(2)加入H2O2的作用是 。
(3)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是
(选填:Fe3+、Al3+、Ca2+、Mg2+)。
Ⅲ.印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤① ② ③过滤。(提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu)
(16分)Ⅰ. 2Al+OH-+NO2-+2H2O=2AlO2-+NH3·H2O (3分)
Ⅱ.(1)250mL容量瓶、胶头滴管 (3分,只写对1个得1分)
(2)氧化Cr3+使之转变成+6价Cr6+,以便于与杂质离子分离(3分)
(3)Ca2+、Mg2+ (3分,只写对1个得1分)
Ⅲ. ①通入足量氯气将Fe2+氧化成Fe3+ (2分)
②加入CuO调节溶液的pH至3.2~4.7(2分)
解析:

 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案