题目内容
下列方法正确的是( )
A、[SiO4]的四面体结构: |
| B、C2H5Cl与NaOH溶液混合加热水解后,加入AgNO3溶液,以检验Cl- |
| C、在MgCl2晶体中含有共价键和离子键 |
| D、0.5g C3H4中含有共用电子对的数目为1×6.02×1023 |
考点:不同晶体的结构微粒及微粒间作用力的区别,常见阴离子的检验
专题:化学键与晶体结构
分析:A、每个Si与4个O结合形成四面体结构;
B、多余的NaOH与AgNO3溶液会形成沉淀;
C、MgCl2晶体中只有离子键;
D、根据分子中共价键数判断.
B、多余的NaOH与AgNO3溶液会形成沉淀;
C、MgCl2晶体中只有离子键;
D、根据分子中共价键数判断.
解答:
解:A、每个Si与4个O结合形成四面体结构,所以[SiO4]的四面体结构: ,故A正确;
,故A正确;
B、C2H5Cl与NaOH溶液混合加热水解后,再加足量稀硝酸中和多余的NaOH,然后加入AgNO3溶液,以检验Cl-,故B错误;
C、MgCl2晶体中镁离子与氯离子形成离子键,晶体中没有共价键,故C错误;
D、1molC3H4中含有4molC-H,1molC-C,1molC≡C,共8mol共用电子对,0.5g C3H4的物质的量为
=0.0125mol,则含有共用电子对的数目为0.1×6.02×1023,故D错误;
故选A.
 ,故A正确;
,故A正确;B、C2H5Cl与NaOH溶液混合加热水解后,再加足量稀硝酸中和多余的NaOH,然后加入AgNO3溶液,以检验Cl-,故B错误;
C、MgCl2晶体中镁离子与氯离子形成离子键,晶体中没有共价键,故C错误;
D、1molC3H4中含有4molC-H,1molC-C,1molC≡C,共8mol共用电子对,0.5g C3H4的物质的量为
| 0.5g |
| 40g/mol |
故选A.
点评:本题考查了晶体结构、氯代烃中氯原子的检验、离子键、共用电子对数的计算等,题目涉及的知识点较多,侧重于基础知识的考查,难度不大.

练习册系列答案
相关题目
下列各组物质中,第一种是酸,第二种是混合物,第三种是碱的是( )
| A、氧化铁、硫酸铜、硫酸 |
| B、氢氟酸、空气、纯碱 |
| C、硝酸、胆矾、熟石灰 |
| D、醋酸、食盐水、烧碱 |
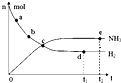 科学家一直致力于“人工固氮”的新方法研究.目前合成氨技术原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1.在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
科学家一直致力于“人工固氮”的新方法研究.目前合成氨技术原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1.在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A、点a的正反应速率比点b的大 |
| B、点c处反应达到化学平衡状态 |
| C、点d和点e处的n(N2)不相同 |
| D、点e反应达到化学平衡状态,反应停止 |
下列数量的各物质所含原子个数由大到小顺序排列的是( )
①0.5mol氨气 ②4g氦气 ③4℃时9mL水 ④0.2mol磷酸钠.
①0.5mol氨气 ②4g氦气 ③4℃时9mL水 ④0.2mol磷酸钠.
| A、④③②① | B、①④③② |
| C、②③④① | D、①④②③ |
下列叙述错误的是( )
| A、1mol硫酸中含有4mol氧原子 | ||
B、1个H2SO4分子的质量约是
| ||
| C、硫酸的摩尔质量是98g | ||
| D、6.02×1023个H2SO4分子的质量约是98g |
化学与科学、技术、社会、环境密切相关.下列有关说法正确的是( )
| A、合金材料中可能含有非金属元素 |
| B、酒精有消毒杀菌作用,医用酒精浓度越大杀菌效果越好 |
| C、地沟油含有有害物质,不能进行加工制生物柴油 |
| D、目前我市的汽油标准已由“国Ⅲ”提到“国Ⅳ”,这意味着汽车不再排放氮的氧化物 |
下列化合物中,既不能与NaOH溶液发生反应,又不能与溴的CCl4溶液发生反应,也不能使酸性KMnO4溶液褪色的是( )
| A、丙烷 | B、乙醇 | C、乙酸 | D、丙烯 |
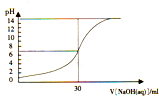 常温下,15ml某待测物质的量浓度的盐酸,用一定物质的量浓度的NaOH溶液滴定的滴定曲线如图所示,则两种溶液的物质量的浓度分别是( )
常温下,15ml某待测物质的量浓度的盐酸,用一定物质的量浓度的NaOH溶液滴定的滴定曲线如图所示,则两种溶液的物质量的浓度分别是( )