��Ŀ����
����Mg��CO2�ķ�Ӧ�Ʋ⣬NaҲ����CO2��ȼ�գ��ҹ���������ΪC��Na2O��Na2CO3�е����ֻ����֡�ij��ȤС��������װ�ÿ�չ�����ε�ʵ��̽����
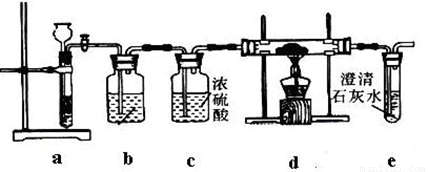
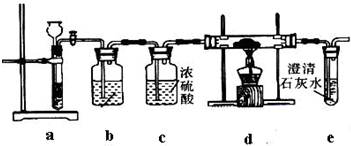
��ʵ��I������CO2��Na��Ӧ����������Ϊ��
�ٰ�ͼ����װ�ã�����װ�������ԣ�������װ���м����Լ���
�ڴ�װ��a�ϻ���һ��ʱ�䣻
�۵�ȼd���ƾ��ƣ�ʹCO2��Na��ַ�Ӧ��ֹͣ���ȣ�����ͨ����ʹ˫ͨ����ȴ��
�ش��������⣺
��1��װ��a���õ��IJ����������Թܺ� ��
��2��װ��b��װ����Լ������������������������� ��
��3��װ��c������������������������������ ��
��4��������У����۲쵽������������������ ʱ�����ܽ��벽��ۡ�
��ʵ���̽����Ӧ���P��Ӧ������ȡ��Ӧ��˫ͨ���й�������29.2 g��������ʵ�飺
����ϸ�۲���壬�����к�ɫ������
�ڽ���������������ˮ�����ˡ�ϴ�ӣ��õ�1.8 g�����������
�۽���Һ��ˮϡ�����250 mL����Һ��
��ȡ�����۵���Һ���ȼ�����BaCl2��Һ���۲쵽��ɫ����,���ù�������Ϊ3.94g���ټӼ��η�̪��Һ����Һ��죻
��ȡ25.00 mL�۵���Һ���μӼ�����Ϊָʾ������3.0 mol��L-1����ζ��������������Ϊ20.00 mL��
�ش��������⣺
��5������жϢ��еĵζ��յ�����������������������
��6����Ӧ��װ��d�еĹ�������Ϊ���������������������� ��ͨ�����������29.2 g���������У�����ֵ��������Ƕ���? ����������������
��1������©����2��,��ܲ��۷֣�
��2������NaHCO3��Һ ��2�֣�
��3������CO2 ��2�֣�
��4��e������ʯ��ˮ����� ��2�֣�
��5�����������һ������ʱ��Һǡ���ɻ�ɫ��Ϊ��ɫ���Ұ�����ڲ���ɫ����2�֣�
��6��C��Na2O��Na2CO3��3�֣�C��1.8g��Na2O��6.2g��Na2CO3��21.2g ��3�֣�
��������
�����������1����ͼ�п��Կ���a�еIJ����������Թܺͳ���©�������߹����˼������շ�������
��2������Ҫ̽������Na��CO2��ȼ�յIJ������Na��CO2 ��Ӧλ��Ӧ����d�е�Ӳ�ʲ������У�����CO2 �����ͨ�롣���aװ����CO2��ȡװ�ã�ʵ�����������ʯ��ʯ��Ӧ��ȡ���Ƶõ�CO2 ����ˮ������HCl���壬����Ҫ���ӣ���ֹ�����������������Ʒ�Ӧ������bװ�ÿ��Գ�ȥHCl���壬Ӧ�ñ���̼��������Һ��
��3��cװ�ó�ˮ���������������̼��
��4��Ϊ�˷�ֹ�����е��������뷴Ӧ��Ӧ�ڷ�Ӧ֮ǰ��ͨ������̼�����ų����������Ե�����e������ʯ��ˮ����ǣ���˵��װ���ѳ���������̼���塣
��5����Ϊ��ζ���ü�����ָʾ�������Եζ��յ�ʱ���ȵ���ɫӦ��Ϊ��ɫ��Ϊ��ɫ�������ж��յ��ǣ����������һ������ʱ��Һǡ���ɻ�ɫ��Ϊ��ɫ���Ұ�����ڲ���ɫ��
��6������ٽ����еõ�1.8g���������Ϊ������̼��
��������������ù�������Ϊ3.94gΪ̼�ᱵ��˵����Ӧ����̼���ƣ�����̼Ԫ���غ��֪��̼���Ƶ����ʵ���=3.94g/197g/mol=0.02mol����29.2g����������n(Na2CO3)=0.02mol��250ml/25ml=0.2mol��m(Na2CO3)=0.2mol��106g/mol=21.2g��
�����������ζ�̼���ƣ�������������ʵ���Ϊ0.02mol��2=0.04mol��ʵ������HClΪ3.0mol•L-1��0.020L=0.06mol������0.02mol������Һ�к����������ƣ�˵����Ӧ�������������ɣ��ζ��������������ĵ�HClΪ0.06mol-0.04mol=0.02mol�������������غ��֪�����Ƶ����ʵ���n(Na2O)=0.02mol/2=0.01mol��������Ϊm(Na2O)=0.1mol��62g/mol=6.2g����1.8g+21.2g+6.2g=29.2g��������ȡ�������ʵ�������������ΪC��Na2O��Na2CO3��
���㣺���⿼�����ʵ��̽���⡣