题目内容
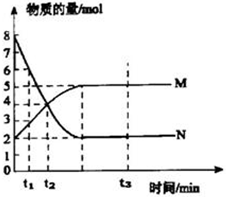
 在一定温度下,M、N两种气体在容积为VL的恒容密闭容器中进行反应,气体的物质的量随时间的变化曲线如图所示:
在一定温度下,M、N两种气体在容积为VL的恒容密闭容器中进行反应,气体的物质的量随时间的变化曲线如图所示:(1)该反应的化学方程式为:
2N M
M
 M
M2N M
M
; M
M(2)若达到平衡状态的时间是2min,N的物质的平均反应速率为1.5mol/(L?min ),则此容器的容积为V=
2
2
L.(3)请写出两个可与提高此时该反应化学反应速率的方法
升温、使用催化剂、增大压强、提高反应物浓度
升温、使用催化剂、增大压强、提高反应物浓度
.分析:(1)根据物质的量的变化与化学计量数呈正比书写化学方程式;
(2)根据v=
和n=cV计算容器的体积;
(3)从外界条件对化学反应速率的影响选择提高此时该反应化学反应速率的方法.
(2)根据v=
| △c |
| △t |
(3)从外界条件对化学反应速率的影响选择提高此时该反应化学反应速率的方法.
解答:解:(1)由图象看出反应从开始到平衡,N的物质的量减小,应为反应物,物质的量变化值为8mol-2mol=6mol,
M的物质的量增多,应为是生成物,物质的量的变化值为5mol-2mol=3mol,
根据物质的量的变化与化学计量数呈正比,
则有n(N):n(M)=6mol:3mol=2:1,所以反应的化学方程式为2N M,
M,
故答案为:2N M;
M;
(2)根据v=
,则2min时N的物质的量浓度变化为△C=1.5mol/(L?min )×2min=3mol/L,
由图象看以看出,达到平衡时,N的物质的量为2mol,则反应的N的物质的量为8mol-2mol=6mol,
所以容器的体积为V=
=
=2L,故答案为:2;
(3)影响化学反应速率的因素有温度、压强、浓度、催化剂等因素,若提高此时该反应化学反应速率,可采取升温、使用催化剂、增大压强、提高反应物浓度等措施,
故答案为:升温、使用催化剂、增大压强、提高反应物浓度.
M的物质的量增多,应为是生成物,物质的量的变化值为5mol-2mol=3mol,
根据物质的量的变化与化学计量数呈正比,
则有n(N):n(M)=6mol:3mol=2:1,所以反应的化学方程式为2N
 M,
M,故答案为:2N
 M;
M;(2)根据v=
| △c |
| △t |
由图象看以看出,达到平衡时,N的物质的量为2mol,则反应的N的物质的量为8mol-2mol=6mol,
所以容器的体积为V=
| △n |
| △c |
| 6mol |
| 3mol/L |
(3)影响化学反应速率的因素有温度、压强、浓度、催化剂等因素,若提高此时该反应化学反应速率,可采取升温、使用催化剂、增大压强、提高反应物浓度等措施,
故答案为:升温、使用催化剂、增大压强、提高反应物浓度.
点评:本题考查化学反应速率的影响因素以及平衡图象题目,题目难度不大,注意把握图象中曲线的变化特点.

练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
 在一定温度下,容器内某一反应中M、N的物质的量随反应时间的变化曲线如图,下列表述中不正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间的变化曲线如图,下列表述中不正确的是( ) 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )