题目内容
下列表示对应化学反应的离子方程式正确的是 ( )。
A.碳酸钠的水解:CO32—+2H2O H2CO3+2OH- H2CO3+2OH- |
| B.硝酸银溶液中滴加过量氨水:Ag++NH3·H2O=AgOH↓+NH4+ |
C.用惰性电极电解氯化镁溶液:2Cl-+2H+ H2↑+Cl2↑ H2↑+Cl2↑ |
| D.用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2+2H+=I2+2H2O |
D
解析

练习册系列答案
相关题目
下列物质中,属于电解质的是 ( )
| A.CO2 | B.乙醇 |
| C.Na2SO4 | D.Cl2 |
能用离子方程式CO32-+2 H+=H2 O+CO2↑表示的反应是
| A.纯碱溶液中加入浓盐酸 | B.小苏打溶液中加人稀硫酸 |
| C.石灰石溶于稀硝酸 | D.碳酸钾溶液中加入醋酸溶液 |
在含1 mol复盐NH4Al(SO4)2液中加入Ba(OH)2溶液,若生成l.6 mol BaSO4沉淀,则生成NH3?H2O的物质的量为
| A.0.8mol | B.l mol | C.0.2mol | D.0.4mol |
某未知溶液中已检验出含大量的Fe2+、SO42—,且pH=1。欲检验此溶液中是否大量存在以下离子:①NH4+、② SiO32—、③Mg2+、④Cl-、⑤Ca2+、⑥ClO-,其中不需要检验就可以否定的离子是( )
| A.①③⑤ | B.②⑤⑥ | C.①②⑥ | D.③④⑥ |
下列说法正确的一组是( )
①不溶于水的盐(CaCO3、BaSO4等)都是弱电解质
②盐都是强电解质
③0.5 mol·L-1的所有一元酸中氢离子浓度都是0.5 mol·L-1
④强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度
⑤电解质溶液导电的原因是溶液中有自由移动的阴、阳离子
⑥熔融的电解质都能导电
| A.①③⑤⑥ | B.②④⑤⑥ | C.只有⑤ | D.只有⑥ |
甲、乙、丙是三种不含相同离子的可溶性强电解质。它们所含离子如表所示:
| 阳离子 | 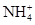 、Na+、Mg2+ 、Na+、Mg2+ |
| 阴离子 | OH-、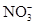 、 、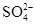 |
取等质量的三种化合物配制相同体积的溶液,其溶质物质的量浓度:c(甲)>c(乙)>c(丙),则乙物质可能是( )
①MgSO4 ②NaOH ③(NH4)2SO4 ④Mg(NO3)2 ⑤NH4NO3
A.①② B.③④ C.③⑤ D.①⑤
下列离子方程式书写正确的是 ( )。
| A.Fe3O4溶于足量稀HNO3:3Fe3O4+28H++NO3—=9Fe3++NO↑+14H2O |
| B.用食醋检验牙膏中碳酸钙的存在:CaCO3+2H+=Ca2++CO2↑+H2O |
| C.FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2=2Fe3++2H2O |
D.电解MgCl2水溶液的离子方程式:2Cl-+2H2O H2↑+Cl2↑+2OH- H2↑+Cl2↑+2OH- |
某混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Ba2+、Cl-、CO32-、SO42-。现取两份200 mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体1.36 g;②第二份加足量BaCl2溶液后,得干燥沉淀12.54 g,经足量盐酸洗涤、干燥后,沉淀质量为4.66 g。根据上述实验事实,以下推测中正确的是( )
| A.一定不存在Ba2+,可能存在NH4+ |
| B.不可能存在Ba2+、Cl- |
| C.Na+一定存在,且c(Na+)≥0.2 mol/L |
| D.Na+、Cl-可能存在 |