题目内容
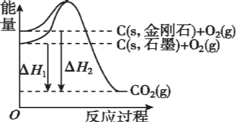
【题目】以氯化氢为原料通过直接氧化法可以制取氯气,反应方程式为:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) 。
(1)该法可按下列催化过程进行:
CuCl2(s)CuCl(s)+![]() Cl2(g) ΔH1=83 kJ·mol-1
Cl2(g) ΔH1=83 kJ·mol-1
CuCl(s)+![]() O2(g)CuO(s)+
O2(g)CuO(s)+![]() Cl2(g) ΔH2=-20 kJ·mol-1
Cl2(g) ΔH2=-20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
①总反应4HCl(g)+O2(g)2Cl2(g)+2H2O(g)的ΔH=____kJ·mol-1。
②有利于提高总反应平衡产率的条件有______。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(2)恒温恒压下,可以说明总反应4HCl(g)+O2(g)2Cl2(g)+2H2O(g)达到平衡的是_________。
A.压强不变
B.氯气的体积分数保持不变
C.每生成2个H—O的同时,有4个H—Cl生成
D.反应速率v正(O2)∶v逆(H2O)=1∶2
E.各组分的物质的量浓度都相等

(3)密闭容器中充入HCl和O2进行反应,c(HCl)随时间t的变化曲线如图1,保持其他条件不变,t2时升温,t3时重新达平衡,画出t2—t4时c(Cl2)随时间t的变化曲线____。
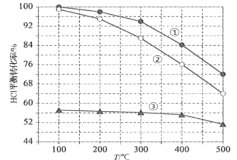
(4)在刚性容器中,进料浓度比c(HCl) ∶c(O2)分别等于1∶1、4∶1、7∶1时,HCl平衡转化率随温度变化的关系如图2:
①其中曲线①代表的c(HCl) ∶c(O2)是__________,原因__________。
②设HCl初始浓度为c0,根据进料浓度比c(HCl)∶c(O2)=4∶1的数据计算K(400℃)=__________(列出计算式,不必算出结果)。
【答案】-116 AD BD 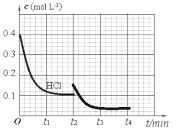 1∶1 温度不变,增大氧气浓度,HCl的平衡转化率增大
1∶1 温度不变,增大氧气浓度,HCl的平衡转化率增大 ![]()
【解析】
(1)①根据盖斯定律分析计算;②根据反应的焓变和气体分子数变化结合化学平衡移动的原理选择适合的反应条件;
(2) 根据化学平衡的特征分析判断;
(3)根据图1可知,起始时c(HCl)=0.4mol/L,平衡时,c(HCl)=0.1mol/L,则平衡时c(Cl2)= 0.15mol/L,保持其他条件不变,t2时升温,平衡逆向移动,达到新平衡时c(Cl2)减小,据此画出t2—t4时c(Cl2)随时间t的变化曲线;
(4)①根据图知,温度一定时进料浓度比c(HCl)∶c(O2)越小,HCl的转化率越大,据此分析判断进料浓度比c(HCl)∶c(O2)=1∶1时HCl的转化率曲线;②400℃时,进料浓度比c(HCl)∶c(O2)=4∶1的HCl转化率为76%,根据三段式计算解答。
(1)①i.CuCl2(s) CuCl(s)+ ![]() Cl2(g) △H1=83kJmol-1,ii.CuCl(s)+
Cl2(g) △H1=83kJmol-1,ii.CuCl(s)+ ![]() O2(g) CuO(s)+
O2(g) CuO(s)+ ![]() Cl2(g) △H2=-20kJmol-1,iii.CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) △H3=-121kJmol-1,根据盖斯定律,(i+ii+iii)×2可得:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) △H=[(83kJmol-1)+( -20kJmol-1)+( -121kJmol-1)]×2=-116kJmol-1,故答案为:-116;
Cl2(g) △H2=-20kJmol-1,iii.CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) △H3=-121kJmol-1,根据盖斯定律,(i+ii+iii)×2可得:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) △H=[(83kJmol-1)+( -20kJmol-1)+( -121kJmol-1)]×2=-116kJmol-1,故答案为:-116;
②总反应为4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) △H=-116kJmol-1,由勒夏特列原理可知,为了提高平衡产率,即平衡需要正向移动,低温和高压符合条件,故答案为:AD;
(2) A.恒温恒压下,压强始终不变,不能判断是平衡状态,故A错误;B.氯气的体积分数保持不变,说明反应达到了平衡状态,故B正确;C.根据方程式4HCl(g)+O2(g) 2Cl2(g)+2H2O(g),生成2个H—O,即生成1个水分子,4个H—Cl生成,即生成4个HCl分子,因此每生成2个H—O的同时,有4个H—Cl生成,说明正、逆反应速率不相等,不是平衡状态,故C错误;D.反应速率v正(O2)∶v逆(H2O)=1∶2,表示正逆反应速率相等,是平衡状态,故D正确;E.各组分的物质的量浓度都相等,不能说明各组分的物质的量浓度是否不变,不能判断是平衡状态,故E错误;故答案为:BD;
(3)根据 4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) △H=-116kJmol-1,结合图1可知,起始时c(HCl)=0.4mol/L,平衡时,c(HCl)=0.1mol/L,则平衡时c(Cl2)= 0.15mol/L,保持其他条件不变,t2时升温,平衡逆向移动,达到新平衡时c(Cl2)减小,t2—t4时c(Cl2)随时间t的变化曲线大致为 ,故答案为:
,故答案为: ;
;
(4)①根据图象,温度一定时,进料浓度比c(HCl)∶c(O2)越小,即增大氧气浓度,HCl的转化率增大,所以进料浓度比c(HCl)∶c(O2)=1∶1时,HCl的转化率在1∶
②400℃时,进料浓度比c(HCl)∶c(O2)=4∶1的HCl转化率为76%,
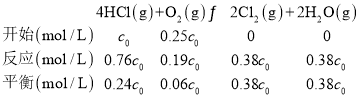
化学平衡常数K=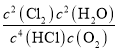 =
=![]() ,故答案为:
,故答案为:![]() 。
。

【题目】已知辉铜矿、软锰矿的主要成分如下表所示:
矿石 | 辉铜矿 | 软锰矿 |
主要成分 | Cu2S、Fe2O3、SiO2 | MnO2、SiO2 |
某化工厂拟以这两种矿石为原料采用湿法冶炼铜,工艺如下:
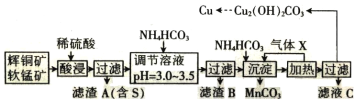
回答下列问题:
(1)气体 X 遇浓硝酸产生“白烟”,写出气体 X 的电子式:______________________________。
(2)提高“酸浸”速率的措施有______________________________(填两条)。
(3)用离子方程式表示“酸浸”中 MnO2 的作用:______________________________,被氧化的元素是______________________________(填元素符号)。
(4)已知 CH3COONH4 溶液呈中性,则常温下,NH4HCO3 溶液 pH______________________________(填“>”、“<”或“=”)7,理由是__________。
(5)从滤液 C 中可以提取一种化学肥料,它的化学式为_____________________________。
(6) 从溶液中析出的碱式碳酸铜可能带有结晶水,设其通式为 Cu2(OH)2CO3·xH2O。准确称取a g 样品,灼烧至恒重,称得 CuO 的质量,固体质量减轻 b g,则 x 为______________________________。