题目内容
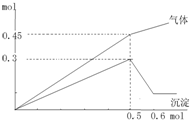
向一定量的Mg2+、NH4+、Al3+的混合液中加入Na2O2的量(横坐标)与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中三种离子的物质的量浓度之比为( )
| A.3:2:1 | B.1:2:2 | C.1:2:4 | D.1:4:5 |

由图可知,沉淀最大时是氢氧化镁、氢氧化铝沉淀,且n[Mg(OH)2]+n[Al(OH)3]=0.3mol,沉淀最小时,需要过氧化钠0.6mol-0.5mol=0.1mol,0.1molNa2O2与水反应生成0.2molNaOH,由反应Al(OH)3+NaOH=NaAlO2+2H2O可知,n[Al(OH)3]=0.2mol,所以n[Mg(OH)2]=0.3mol-0.2mol=0.1mol,根据镁元素可知原溶液中n(Mg2+)=n[Mg(OH)2]=0.1mol,根据铝元素守恒可知n(Al3+)=n[Al(OH)3]=0.2mol.
生成的气体为氨气与氧气,右图可知溶液加入0.05molNa2O2以后,再加Na2O2,气体的增加减少,故加入0.05molNa2O2时,NH4+完全反应,沉淀达最大值,故溶液中Mg2+、NH4+、Al3+都恰好完全反应,此时溶液中Mg2+、NH4+、Al3+为Na+代替,溶液中n(Na+)=2n(Na2O2)=2×0.5mol=1mol,根据电荷守恒有n(Na+)=2n(Mg2+)+n(NH4+)+3n(Al3+),即1mol=2×0.1mol+n(NH4+)+3×0.2mol,所以n(NH4+)=0.2mol.
所以溶液中三种离子的物质的量浓度之比为n(Mg2+):n(NH4+):n(Al3+)=0.1mol:0.2mol:0.2mol=1:2:2.
故选:B.
生成的气体为氨气与氧气,右图可知溶液加入0.05molNa2O2以后,再加Na2O2,气体的增加减少,故加入0.05molNa2O2时,NH4+完全反应,沉淀达最大值,故溶液中Mg2+、NH4+、Al3+都恰好完全反应,此时溶液中Mg2+、NH4+、Al3+为Na+代替,溶液中n(Na+)=2n(Na2O2)=2×0.5mol=1mol,根据电荷守恒有n(Na+)=2n(Mg2+)+n(NH4+)+3n(Al3+),即1mol=2×0.1mol+n(NH4+)+3×0.2mol,所以n(NH4+)=0.2mol.
所以溶液中三种离子的物质的量浓度之比为n(Mg2+):n(NH4+):n(Al3+)=0.1mol:0.2mol:0.2mol=1:2:2.
故选:B.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案
相关题目
 向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中NH4+、Mg2+、Al3+三种离子的物质的量之比为( )
向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中NH4+、Mg2+、Al3+三种离子的物质的量之比为( ) 向一定量的Mg2+、NH4+、Al3+的混合液中加入Na2O2的量(横坐标)与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中三种离子的物质的量浓度之比为( )
向一定量的Mg2+、NH4+、Al3+的混合液中加入Na2O2的量(横坐标)与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中三种离子的物质的量浓度之比为( ) (2011?琼海一模)向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中三种离子的物质的量之比为( )
(2011?琼海一模)向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中三种离子的物质的量之比为( )
