题目内容
锂离子电池的广泛应用使得锂电池的回收利用一直是科学家关注的焦点。磷酸铁锂是锂电池中最有前景的正极材料,磷酸铁是其前驱体,充放电时可以实现相互转化。某研究性小组对废旧锂离子电池正极材料(图中简称废料,成份为LiFePO4、碳粉和铝箔)进行金属资源回收研究,设计实验流程如下:
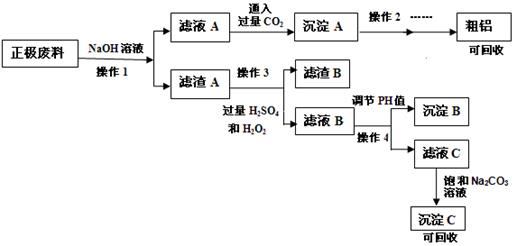
已知:① FePO4可溶于稀H2SO4,不溶于水和其他的酸。
② Li2SO4、LiOH和Li2CO3在273K下的溶解度分别为34.2g、22.7g和1.54g,
在373K下,Li2CO3的溶解度为0.72g
③ Ksp[Al(OH)3]=10-32 Ksp[Fe(OH)3]=4×10-38
(1)操作1为: 。
(2)滤液A中通入过量CO2的化学方程式为: 。
(3)可以提高操作1浸出率的方法有(写出3种) 。
(4)完成操作3中的离子方程式: 。
(5)该锂电池充电时的阳极反应式: 。
(6)操作4中应选择试剂: 。
(7)沉淀C的成分: 。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案①加水溶解; ②加热蒸发结晶; ③加入过量氯化钡溶液; ④加入过量盐酸;
⑤加入过量碳酸钾溶液; ⑥过滤。下列操作顺序正确的是
A. ①③⑤⑥④② B. ①⑤③④⑥②
C. ①③④⑥⑤② D. ①⑤③⑥④②
CaS可用于制备发光漆、用作脱毛剂、杀虫剂、硫脲等,还用于医药工业、重金属处理及环保中。某化学探究小组在实验室中利用反应: CaSO4+C CaS+CaO+SO2↑+CO↑+CO2↑制备硫化钙并检验产物,可选用的装置如下。回答下列问题:
CaS+CaO+SO2↑+CO↑+CO2↑制备硫化钙并检验产物,可选用的装置如下。回答下列问题:
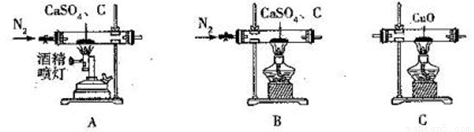

已知:①C及E ~ H中的试剂均为足量。
②酸性KMnO4溶液作氧化剂时,锰元素被还原成Mn2+
③CaS与H2O反应生成Ca(OH)2和H2S。
(1)实验1:若只检验生成物中是否含有CO,可采用的装置组合为______(按气流方向,填字母组合),生成物中存在CO的现象是________________________。
(2)实验2:若只检验生成物中是否含有CO2,可釆用的最简单的装置组合为______(按气流方向,填字母组合),除去SO2的离子方程式为__________________________。
(3)实验3:若同时检验CO2和SO2,采用的装置组合为_______ (按气流方向,填字母组合)。
(4)若制备反应的条件完全相同,将产生的气体全部通入上述实验装置中,得到的有关数据如下表:
实验前 | 实验后 | |
实验1 | 装置C硬质玻璃管连同CuO质量为26.80 g | 装置C硬质玻璃管连同反应后固体质量为26.64 g |
实验2 | 装置G连同溶液质量为187.50g | 装置G连同反应后溶液及沉淀的质量为188.38 g |
实验3 | 装置D、H连同溶液质量和为373.60g | 装置D、H连同溶液质量和为374.24 g |
写出CaSO4和焦炭在高温条件下反应生成CaS的化学方程式:_______________。
(5)为了证明硫化钙的化学式设计如下实验:将一定质量(m1)的样品溶于足量的饱和Na2CO3溶液中,通过____操作,称得固体质量为m2,则表示硫化钙组成的计算式为n(Ca):n(S)=__________(用含m1 、m2的代数式表示)。
某工业废水中仅含下表离子中的5种:
阳离子 | K+ Cu2+ Fe3+ Ca2+ Fe2+ |
阴离子 | Cl- CO32- NO3- SO42- SiO32- |
某同学欲探究废水的组成,进行了如下实验:
Ⅰ.取废水少许加入少量盐酸,无白色沉淀析出,但生成能使澄清石灰水变浑浊的无色无味气体
Ⅱ.向Ⅰ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
下列推断不正确的是
A. 溶液中一定含有的阳离子是K+ 、 Cl- 、CO32- 、NO3- 、 SO42-
B. Ⅰ中加入盐酸生成无色气体的的离子方程式是CO32-+2H+=CO2↑+H2O
C. 原溶液中的K+ 、 Cl- 、NO3- 存在与否无法确定
D. Ⅱ中产生白色沉淀的离子方程式是Ba2++SO42-=BaSO4↓


 个分子的CO中,
个分子的CO中, 。
。
 的
的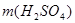 = 。
= 。
 在标准状况下的
在标准状况下的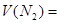 。
。
 溶液中所含
溶液中所含 。
。 某二价金属氯化物(
某二价金属氯化物(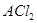 )中含有
)中含有 ,则A的相对原子质量= 。
,则A的相对原子质量= 。
 个该原子 D. 由已知信息可得:
个该原子 D. 由已知信息可得: [
[